Bilanciamento delle reazioni chimiche
inserita 06-12-2020
Regole di Base
Premesse
“ Il significato di una reazione chimica „
Nel corso di una reazione chimica una o più sostanze (elementi o composti) si trasformano in uno o più prodotti (elementi o composti)
Per convenzione le sostanze presenti all'inizio della reazione i REAGENTI si scrivono a sinistra e quelle presenti al termine della reazione i PRODOTTI si scrivono a destra.
I due gruppi sono separati da una freccia che indica la DIREZIONE della reazione.
reagenti -----> prodotti
In base alle leggi ponderali stabilite da Lavoisier, Proust e Dalton, le leggi tre leggi fondanti della chimica moderna, noi sappiamo che:
1- Nel corso di una reazione chimica la materia non si crea né si distrugge
2- Una sostanza ha SEMPRE la stessa composizione chimica (quindi non posso cambiare MAI la formula chimica di una sostanza per bilanciare la reazione)
3- E soprattutto non si creano né scompaiono gli atomi dei diversi elementi.
Per cui se ho 6 atomi di Ossigeno a sinistra, all'inizio della reazione, ne devo ritrovare 6 a destra alla fine della reazione.
Quello che devo fare è capire QUANTE molecole (o particelle fondamentali) di ogni sostanza entrano in gioco durante la reazione.
SIMBOLOGIA
LE FORMULE CHIMICHE:
“ Le Formule chimiche non possono essere modificate „
Le formule chimiche identificano le sostanze pure, composti o elementi, che partecipano alla reazione. Ogni Formula indica QUALI elementi e QUANTI ATOMI di ogni elemento costituiscono la sostanza pura.
REGOLA 1: Non è assolutamente concesso cambiare le formule delle sostanze chimiche.
Se io ad esempio nel corso di un bilanciamento ho la bella idea di trasformare l'acqua H2O in H2O2, per bilanciare l'ossigeno ho alterato la reazione!
H2O2 non è più acqua, fresca e dissetante ma acqua ossigenata, tossica e irritante.
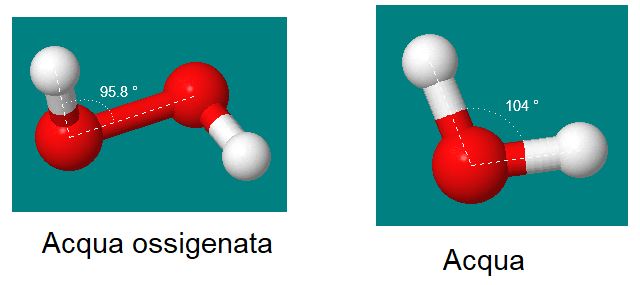
Convenzioni di base
Quando il numero di atomi in una molecola è 1 non si scrive.
Per esempio io scrivo H2O e non H2O1
Gruppi di atomi tra parentesi
Quando un gruppo di atomi è racchiuso in una parentesi tonda con un numeretto a destra, vuol dire che tutti gli atomi presenti devono essere moltiplicati per quel numeretto a destra.
Si tratta generalmente di ioni poliatomici (ioni formati da più atomi legati con legami covalenti)
Ad esempio il sale Nitrato Piomboso

Quindi sono due gruppi NO3 che rappresentiamo racchiusi nella parentesi affiancata dal numero 2.
nella formula sono quindi: 1 Pb + Nx2 + O 3 x 2 cioè 1 atomo di Piombo, 2 di azoto e 6 di ossigeno.
Ovviamente neanche il numero a destra della parentesi può essere modificato. Alterare il numero a lato della parentesi vuol dire ancora una volta cambiare la sostanza coinvolta nella reazione.
I COEFFICIENTI STECHIOMETRICI:
“ Cosa sono i coefficienti stechiometrici? „
In definitiva cosa posso fare quando devo bilanciare una reazione?
Posso solo cambiare i numeri davanti alle molecole, i coefficienti stechiometrici, che indicano il numero di molecole di ogni sostanza coinvolte nella reazione, in modo che la somma degli atomi di ogni elemento presenti a sinistra dell'equazione sia uguale alla somma degli atomi dello stesso elemento presenti a destra.
Ricordiamo sempre che gli atomi di ogni elemento possono solo essere scambiati e "spostarsi" nei vari composti, ma non comparire o scomparire dall'equazione.
Coefficiente uguale a 1
Anche per i Coefficienti stechiometrici, quando è uguale a 1, NON SI SCRIVE!!!
Ricapitolando
Il numero di atomi di ogni elemento presenti all'inizio della reazione deve essere uguale al numero degli atomi dello stesso elemento presenti alla fine della reazione
Il Bilanciamento di una reazione si risolve quindi nella ricerca dei corretti coefficienti stechiometrici per ogni sostanza che partecipa alla reazione.
Se davanti alla formula chimica di una sostanza ho il numero 2, allora vorrà dire che in quella reazione partecipano DUE molecole della sostanza, se ho il numero 3, TRE molecole e così via.
Per convenzione il coefficiente stechiometrico 1 non si scrive. Per cui se in quella reazione partecipa solo una molecola della sostanza davanti alla sua formula non metto nessun numero.
Per cui io scriverò in questo modo:
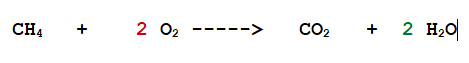
E non in questo:
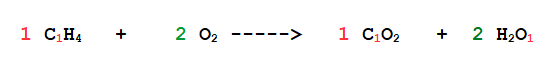
Video-lezione con le simulazioni PHET
Link di riferimento:
PHET - Bilanciamento reazioni
PHET - Reagenti, prodotti e residui
Un esempio
“ L'ossidazione del Metano „
Quando vi si dà un esercizio di bilanciamento l'equazione di reazione è PRIVA dei coefficienti stechiometrici.
Sono quelli che dovete trovare!
Prendiamo ad esempio l'ossidazione del Metano che abbiamo visto sopra (già bilanciata) e togliamo i coefficienti stechiometrici:
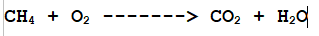
L'equazione sopra non è quindi completamente veritiera. A sinistra abbiamo 4 atomi di idrogeno e a destra 2; a sinistra abbiamo 2 atomi di ossigeno a destra 3.
Cosa significa?
Significa che le quattro sostanze non reagiscono tra loro in un semplice rapporto numerico 1,1,1,1
Occorre quindi stabilire il loro reale rapporto numerico di reazione. E questo si fa attraverso il
Bilanciamento di una reazione chimica
“ Il bilanciamento di una reazione chimica „
Dobbiamo trovare il reale rapporto numerico di interazione delle sostanze nella reazione.
Dobbiamo attribuire dei numeri, che scriviamo a sinistra della formula chimica di ogni sostanza (1 non si scrive per convenzione) che diano l'informazione di quante molecole della sostanza sono impegnate nella reazione.
Andiamo per tentativi:
1- Il carbonio è già bilanciato 1 a sinistra ----> 1 a destra
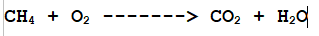
2- L'idrogeno no. Ce ne sono 4 a sinistra e 2 a destra. Vorrà dire che per ogni molecola di metano che reagisce se ne formano 2 di acqua.
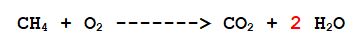
3- L'Ossigeno: ce ne sono 2 a sinistra e 4 in totale a destra (2 nella molecola di anidride carbonica e 2 nelle due molecole di acqua) Sistemiamolo.
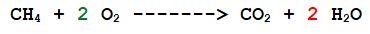
Ora abbiamo il corretto rapporto numerico di reazione delle molecole.
1 molecola di metano reagisce con 2 molecole di ossigeno per dare 1 molecola di anidride carbonica e 2 molecole di acqua.
I numeri interi che indicano il numero di molecole che intervengono nella reazione si chiamano COEFFICIENTI STECHIOMETRICI.
