esercizi svolti sul bilanciamento di reazioni chimiche
inserita 07-12-2020
Procedura operativa
Come procedere
“ Alcune procedure pratiche per risolvere più velocemente un bilanciamento „
Il significato del bilanciamento delle reazioni chimiche e simboli e convenzioni usate sono state discusse nel post precedente: Bilanciamento delle reazioni chimiche regole di base
Per bilanciare una reazione chimica si procede per tentativi.
Può essere conveniente procedere in questo modo
- Cominciare dai metalli e/o dai non-metalli, MAI da Idrogeno e Ossigeno che sono spesso presenti in parecchie molecole o sostanze.
- Partire sempre nel bilanciamento dagli elementi presenti nel numero minore di molecole (possibilmente una a destra e una a sinistra)
- Quando alla fine restano da bilanciare Idrogeno e Ossigeno partire da quello presente nel minor numero di molecole
- Quando ci sono ioni poliatomici, ricordare che si "spostano" dai reagenti ai prodotti come unità intere.
Esercizi risolti
Livello base
Sintesi dell'acido fosforoso da anidride fosforosa e acqua
“ Sintesi dell'acido fosforoso „
Reazione non bilanciata
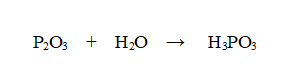
Tipo di reazione: Reazione di sintesi
Nello specifico l'anidride fosforosa reagisce con l'acqua per dare acido fosforoso.
è bilanciata?
No. Nessuno dei tre elementi è bilanciato
1- Iniziamo a bilanciare il Fosforo (P) - non-metallo
A sinistra ne abbiamo 2 e a destra uno soltanto. Aggiungiamo un 2 davanti all'acido fosforoso.
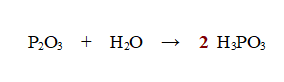
2- Dato che l'Ossigeno (O) è presente in tutte e tre le molecole è più conveniente bilanciare l'Idrogeno (H).
Ce ne sono 6 a destra e solo 2 a sinistra, per cui mettiamo un 3 davanti alla molecola di acqua.
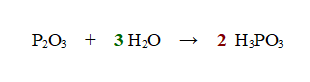
Se contiamo gli atomi di Ossigeno vediamo che ora sono bilanciati, per cui l'esercizio è stato svolto correttamente.
QUINDI: 1 molecola di anidride fosforosa reagisce con 3 molecole di acqua per dare 2 molecole di acido fosforoso
Video-esempio con le simulazioni PHET
Link di riferimento:
PHET - Bilanciamento reazioni
PHET - Reagenti, prodotti e residui
Esercizi risolti
Livello base
Sintesi dell'anidride clorica dagli elementi
“ Sintesi dell'anidride clorica „
Reazione non bilanciata
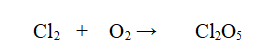
Tipo di reazione: Reazione di sintesi
Nello specifico Cloro (Cl) e Ossigeno (O) molecolari reagiscono per dare l'anidride clorica.
è bilanciata?
No. Il cloro è bilanciato ma l'Ossigeno no. Ce ne sono 2 a sinistra e 5 a destra.
Inoltre a sinistra sono in numero pari e a destra in numero dispari.
1- Per prima cosa rendiamo pari anche gli atomi di Ossigeno a destra, mettendo 2 come coefficiente stechiometrico davanti all'anidride clorica.
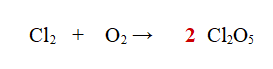
2- Ora possiamo dare all'Ossigeno il coefficiente stechiometrico 5, per bilanciare gli atomi dell'elemento. (10 a sinistra e 10 a destra)
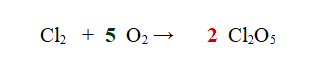
3- Ora bilanciamo facilmente il Cloro mettendo un 2 davanti alla sua molecola (4 a destra e 4 a sinistra)
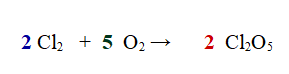
Se contiamo gli atomi di ogni elemento vediamo che ora sono bilanciati, per cui l'esercizio è stato svolto correttamente.
QUINDI: 2 molecole di Cloro reagiscono con 5 molecole di Ossigeno per dare 2 molecole di Anidride Clorica
Esercizi risolti
Livello base
Sintesi dell'idrossido ferrico dall'ossido
“ Sintesi dell'idrossido ferrico „
Reazione non bilanciata
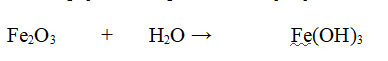
Tipo di reazione: Reazione di sintesi
Nello specifico l'Ossido Ferrico Fe2O3 reagisce con l'acqua per dare l'Idrossido Ferrico Fe(OH)3
è bilanciata?
No. Nessuno dei tre elementi Ferro (Fe), Ossigeno (O) e Idrogeno (H) è bilanciato.
1- Per prima cosa Bilanciamo il Ferro (Fe). Ce ne sono 2 a sinistra e uno a destra. Mettiamo un 2 davanti all'idrossido ferrico.
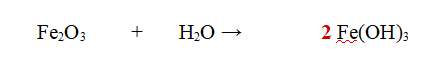
2- Ora bilanciamo l'Idrogeno che è presente solo in due molecole, mentre l'Ossigeno è in tutte e tre.
Ricordate il numero a destra della parentesi moltiplica tutti gli elementi dentro la parentesi (in questo caso Ossigeno e Idrogeno)
Per cui a sinistra abbiamo 2 atomi di Idrogeno, nell'acqua, mentre a destra ben 6 atomi (2x3), quindi mettiamo un 2 davanti alla molecola d'acqua.
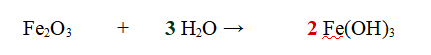
Se contiamo adesso gli atomi di Ossigeno ci accorgiamo che sono bilanciati (6 a sinistra e 6 a destra), per cui l'esercizio è stato svolto correttamente.
QUINDI: 1 molecola di ossido ferrico reagisce con 3 molecole di acqua per dare 2 molecole di idrossido Ferrico (tecnicamente non è corretto chiamare molecole Ossido e Idrossido in quanto composti ionici, ma per questi esercizi non ci formalizziamo)
Esercizi risolti
Livello base
Decomposizione del Solfato di Sodio
“ Decomposizione del Solfato di Sodio „
Reazione proposta
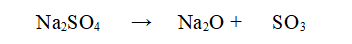
Tipo di reazione: Reazione di decomposizione
Nello specifico il Solfato di Sodio Na2SO4 si decompone al calore per formare Ossido di Sodio (Na2O) e anidride Solforica (SO3)
è bilanciata?
Sì. Tutte e tre gli elementi Sodio (Na), Ossigeno (O) e Zolfo (S) sono bilanciati.
QUINDI: Quindi quando il Solfato di Sodio si decompone al calore libera 1 molecola di Ossido di Sodio e una di Anidride Solforica in rapporto 1:1:1.
Per cui raramente le equazioni di reazione sono già bilanciate e i coefficienti stechiometrici sono tutti uguali a 1
