esercizi svolti sul bilanciamento di reazioni chimiche
inserita 09-12-2020
Esercizi risolti
Livello base
Solfato mercuroso più idrossido di sodio
“ Formazione di Idrossido Mercuroso e Solfato di Sodio „
Reazione non bilanciata

Tipo di reazione: Reazione di doppio Scambio
Nello specifico il Solfato mercuroso Hg2SO4 reagisce con l'Idrossido di Sodio NaOH per dare Idrossido Mercuroso HgOH e Solfato di Sodio Na2SO4.
è bilanciata?
No. Il sodio (Na) non è bilanciato e neanche il mercurio (Hg)
1- Iniziamo a bilanciare il Sodio (Na).
A sinistra ne abbiamo 1 e a destra 2. Aggiungiamo un 2 davanti all'Idrossido di Sodio.
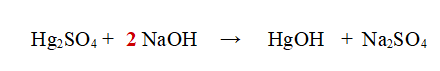
2- Ora bilanciamo il mercurio Hg, mettendo un 2 davanti all'Idrossido Mercuroso
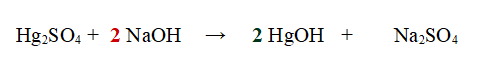
Se controlliamo gli altri elementi ci accorgiamo che sono bilanciati:
un atomo di Zolfo (S) a sinistra e uno a destra
6 atomi di Ossigeno a sinistra e 6 a destra
2 atomi di Idrogeno a sinistra e 2 a destra
per cui l'esercizio è stato svolto correttamente.
QUINDI: 1 molecola di solfato mercuroso reagisce con 2 molecole di idrossido di sodio per dare 2 molecole di idrossido mercuroso e 1 molecola di solfato di sodio (tecnicamente non è corretto chiamare molecole solfato e Idrossido in quanto composti ionici, ma per questi esercizi non ci formalizziamo)
Video-esempio con le simulazioni PHET
Link di riferimento:
PHET - Bilanciamento reazioni
PHET - Reagenti, prodotti e residui
Esercizi risolti
Livello base
Metallo + acido per dare sale + idrogeno
“ Spostamento dell'Idrogeno dall'acido ad opera del Magnesio „
Reazione non bilanciata
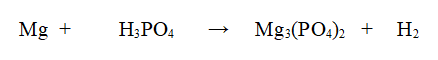
Tipo di reazione: Reazione di Scambio semplice o spostamento
Nello specifico il Magnesio metallico sposta l'idrogeno dall'acido fosforico e si associa al Fosfato per dare Fosfato di Magnesio e Idrogeno molecolare.
è bilanciata?
No. Nessun elemento è bilanciato.
1- Iniziamo a bilanciare il Magnesio (Mg). Ce n'è uno a sinistra e 3 a destra. Aggiungiamo 3 al Magnesio.
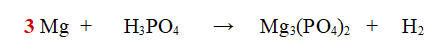
2- Passiamo all'idrogeno. Ce ne sono 3 a sinistra e 2 a destra. Mettiamo un 3 davanti ad H2 e un 2 davanti all'acido fosforico, così ne abbiamo 6 per parte.
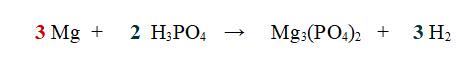
Se ora controlliamo il Fosforo (P) e l'Ossigeno ci accorgiamo che sono bilanciati.
2 atomi di Fosforo a sinistra e 2 a destra (il fosforo è dentro la parentesi per cui è moltiplicato per 2)
8 atomi di Ossigeno a sinistra e 8 a destra. Per cui l'esercizio è stato svolto correttamente.
QUINDI: 3 atomi di Magnesio reagiscono con 2 molecole di Acido Fosforico per dare 1 molecola di Fosfato di Magnesio e 3 molecole di Idrogeno.
Esercizi risolti
Livello base
Spostamento dell'idrogeno dall'acido nitrico
“ Formazione del Nitrato di Potassio „
Reazione non bilanciata

Tipo di reazione: Reazione di Scambio semplice o spostamento analoga alla precedente
Un metallo, il Potassio (K), reagisce con un acido, in questo caso Acido Nitrico HNO3, per dare un sale, il Nitrato di Potassio KNO3 e Idrogeno gassoso
è bilanciata?
No. l'Idrogeno non è bilanciato.
1 - Aggiungiamo un 2 all'acido Nitrico

2 -Ora l'Azoto (N) non è bilanciato. Aggiungiamo un 2 al Nitrato di Potassio.
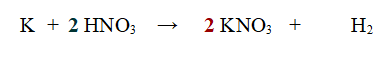
3 -Ora il Potassio non è più bilanciato, per cui aggiungiamo un 2 davanti a K.
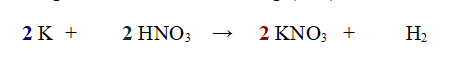
Se contiamo adesso gli atomi di Ossigeno ci accorgiamo che sono bilanciati (6 a sinistra e 6 a destra), per cui l'esercizio è stato svolto correttamente.
QUINDI:2 atomi di Potassio reagiscono con 2 molecole di Acido Nitrico per dare 2 molecole di Nitrato di Potassio e 1 molecola di Idrogeno.
Esercizi risolti
Livello base
Formazione di un sale
“ Formazione di un sale da acido + idrossido „
Reazione proposta
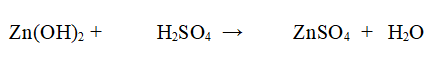
Tipo di reazione: Reazione di doppio Scambio
Nello specifico l'idrossido di Zinco Zn(OH)2 reagisce con l'Acido Solforico per dare Solfato di Zinco ZnSO4 e acqua
è bilanciata?
No. Idrogeno e Ossigeno non sono bilanciati. Proviamo a vedere se operando solo sull'acqua possiamo bilanciarla facilmente.
A sinistra abbiamo 4 atomi di Idrogeno a destra 2
A sinistra abbiamo 6 atomi di Ossigeno a destra 5
Per cui basta mettere un 2 come coefficiente davanti all'acqua e la reazione è bilanciata.
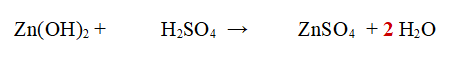
QUINDI: Una molecola di idrossido di Zinco Zn(OH)2 reagisce con una molecola di Acido Solforico per dare una molecola di Solfato di Zinco ZnSO4 e 2 molecole di acqua
