esercizi svolti sul bilanciamento di reazioni chimiche
inserita 10-12-2020
Esercizi risolti
Livello medio
La reazione riassuntiva della fotosintesi
“ Nella fotosintesi acqua e anidride carbonica si combinano per dare glucosio e ossigeno „
Reazione non bilanciata

Tipo di reazione: Ossidoriduzione
1- La prima reazione da bilanciare è universalmente famosa. L'equazione di reazione della fotosintesi. Le piante utilizzano l'energia luminosa per combinare anidride carbonica e acqua e sintetizzare il Glucosio e una certa quantità di Ossigeno.
è bilanciata?
No. A sinistra abbiamo un C a destra 6, a sinistra 2 H a destra 12, a sinistra 3 O complessivi e a destra 8.
Come norma pratica conviene prima bilanciare non-Metalli o Metalli presenti, poi l'Idrogeno, che è presente solo in due molecole e solo alla fine l'Ossigeno che è presente in tutte e quattro le molecole.
1- Iniziamo quindi a bilanciare il Carbonio (C).
A sinistra ne abbiamo 1 e a destra 6. Aggiungiamo un 6 davanti all'Anidride Carbonica.
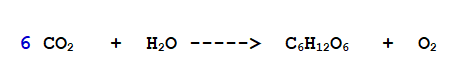
2- Ora bilanciamo l'Idrogeno. Nel Glucosio ce ne sono 12 nell'acqua soltanto 2. Mettiamo 6 come coefficiente stechiometrico davanti all'acqua.
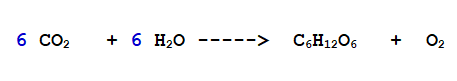
Ora è semplice bilanciare gli atomi di Ossigeno, dato che nella parte destra abbiamo Ossigeno molecolare.
Ora a sinistra sono presenti complessivamente 18 atomi di Ossigeno, 6 in 6 molecole di acqua e 12 in 6 molecole di Anidride Carbonica.
A destra ne abbiamo 6 nel Glucosio. Se nella reazione intervengono 6 molecole di O2, il numero di atomi di Ossigeno è bilanciato.
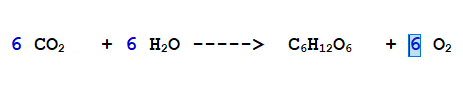
QUINDI: L'equazione è bilanciata.
Carbonio 6 a sinistra e 6 a destra
Idrogeno 12 a sinistra e 12 a destra
Ossigeno 18 (12 nella CO2 e 6 nell'acqua) a sinistra e 18 (6 nel glucosio e 12 nell'Ossigeno molecolare) a destra.
Video-esempio con le simulazioni PHET
Link di riferimento:
PHET - Bilanciamento reazioni
PHET - Reagenti, prodotti e residui
Esercizi risolti
Livello medio
Reazione Acido-Base di neutralizzazione
“ Reazione di neutralizzazione con formazione di sale e acqua „
Reazione non bilanciata
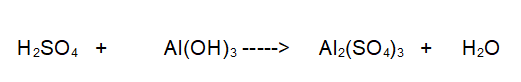
Tipo di reazione: Reazione Acido-Base
La seconda reazione da bilanciare è una reazione acido-base con formazione di sale e acqua. Acido solforico + idrossido di alluminio che danno solfato di Alluminio e acqua.
è bilanciata?
No. A sinistra abbiamo un solo Al a destra 2, a sinistra un solo S a destra 3 (c'è la parentesi!), a sinistra 5 H a destra 2, a sinistra 7 O complessivi e a destra 13.
Le 4 sostanze chiaramente non reagiscono in rapporto 1:1:1:1
Come norma pratica conviene prima bilanciare non-Metalli o Metalli presenti, poi l'Idrogeno, che è presente solo in tre molecole e solo alla fine l'Ossigeno che è presente in tutte e quattro le molecole.
(Trucco: in queste reazioni acido-base conviene ignorare l'Acqua e bilanciarla solo alla fine)
1- Iniziamo a bilanciare lo Zolfo (S). Ce n'è uno a sinistra e 3 a destra. Aggiungiamo 3 all'acido Solforico.
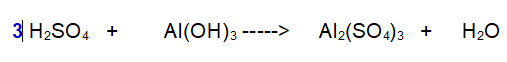
2- Passiamo all'Alluminio (Al). Ce n'è 1 a sinistra e 2 a destra. Mettiamo un 2 davanti all'Idrossido di Alluminio.
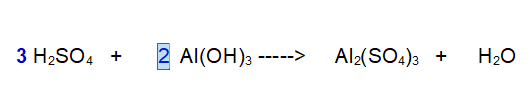
3- Idrogeno. A sinistra ce ne sono 12 complessivi a destra solo 2. Servono più molecole di acqua. Ce ne vogliono 6 per contenere 12 atomi di idrogeno
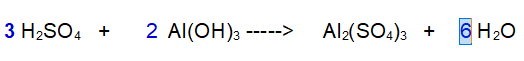
Controlliamo che l'Ossigeno sia corretto. A sinistra ce ne sono 12 + 6; a destra ce ne sono 12 + 6. L'equazione è bilanciata.
QUINDI: 3 molecole di Acido Solforico reagiscono con 2 molecole di Idrossido di Alluminio, per dare 1 molecola di Solfato di Alluminio e ben 6 molecole di acqua.
Esercizi risolti
Livello medio
Combustione del Pentano
“ Combustione del Pentano „
Reazione non bilanciata
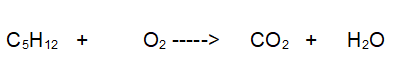
Tipo di reazione: Ossido-Riduzione
La terza reazione da bilanciare è l'ossidazione di un idrocarburo il PENTANO che reagisce con l'OSSIGENO per dare ANIDRIDE CARBONICA e ACQUA
è bilanciata?
No.A sinistra abbiamo 5 C a destra 1, a sinistra 12 H a destra 2, a sinistra 2 O e a destra complessivi 3. Le 4 sostanze chiaramente non reagiscono in rapporto 1:1:1:1
Come norma pratica conviene prima bilanciare non-Metalli o Metalli presenti, poi l'Idrogeno, che è presente solo in due molecole e solo alla fine l'Ossigeno che è presente in tre molecole.
1 - Carbonio (C). Dobbiamo mettere 5 davanti all'anidride Carbonica

2 -Idrogeno (H) Dobbiamo mettere 6 davanti all'acqua.

3 - Ossigeno. A sinistra ce ne sono solo 2 a destra ce ne sono complessivi 10 + 6. Quindi occorrono 8 molecole di Ossigeno biatomico per ossidare il Pentano.
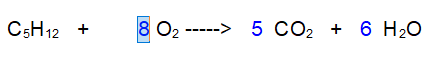
Se contiamo adesso gli atomi di Ossigeno ci accorgiamo che sono bilanciati (16 a sinistra e 16 a destra), per cui l'esercizio è stato svolto correttamente.
QUINDI: per ossidare 1 molecola di PENTANO occorrono 8 molecole di OSSIGENO e si formano 5 molecole di ANIDRIDE CARBONICA e 6 molecole di ACQUA.
