esercizi svolti sul bilanciamento di reazioni chimiche
inserita 11-12-2020
Esercizi risolti
Livello medio
Riduzione del Ferro dalla Magnetite
“ Formazione di Ferro metallico per opera del Monossido di Carbonio „
Reazione non bilanciata
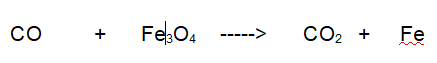
Tipo di reazione: Ossidoriduzione
1-La prima reazione da bilanciare è una ossidoriduzione. Il Monossido di Carbonio viene ossidato dalla Magnetite ad Anidride Carbonica mentre il Ferro si riduce a Ferro metallico.
è bilanciata?
No. L'equazione non è bilanciata. A sinistra abbiamo 3 Fe a destra 1, a sinistra 5 O a destra 2.
Anche se le ossidoriduzioni prevedono procedure più complete e complesse per il bilanciamento queste relativamente semplici possiamo bilanciarle con le poche regole che abbiamo usato finora. Concentriamoci solo sul monossido di carbonio e sull'anidride carbonica
1- Ossigeno. A sinistra è dispari a destra e pari.
Intanto raddoppiamo le molecole di Monossido e di anidride carbonica, in modo da avere un numero pari di atomi di Ossigeno a destra e a sinistra.
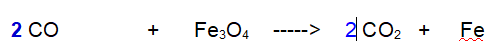
2- Non abbiamo risolto molto. A sinistra abbiamo 6 atomi di Ossigeno a destra 4.
Però è facile vedere che se raddoppiamo ancora le due molecole otteniamo 8 atomi di Ossigeno sia a destra che a sinistra
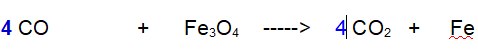
Il Ferro l'abbiamo lasciato per ultimo tanto a destra si trova isolato e basta aggiungere 3.
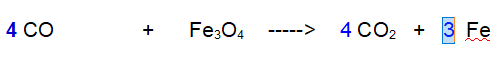
QUINDI: Quindi occorrono 4 molecole di Monossido per ridurre i 3 atomi di Ferro della magnetite, con formazione di 4 molecole di anidride carbonica e Ferro metallico.
Appendice:
Dato che è una reazione redox verifichiamo che il numero di elettroni ceduti dal carbonio (il cui numero di ossidazione passa da +2 a +4) nella reazione bilanciata sia uguale a quello di elettroni ricevuti dal Ferro (nella magnetite 2 atomi di Ferro hanno numero di ossidazione +3 e uno ha numero di ossidazione +2, il Ferro metallico ha ovviamente numero di ossidazione 0)
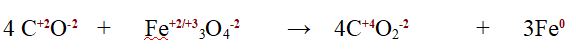
semireazione di ossidazione del Carbonio 4 C+2 --> 4 C+4 + 8 e-
semireazione di riduzione del Ferro 2 Fe3+ + 1 Fe2+ + 8e- --> 3 Fe0
Il numero di elettroni è lo stesso per cui abbiamo verificato che la redox è correttamente bilanciata anche nel numero di elettroni scambiati
Video-esempio con le simulazioni PHET
Link di riferimento:
PHET - Bilanciamento reazioni
PHET - Reagenti, prodotti e residui
Esercizi risolti
Livello medio
Formazione di Ossido di Nichel
“ Ossidazione del Cloro ad opera di Ossigeno molecolare „
Reazione non bilanciata
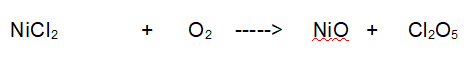
Tipo di reazione: Ossidoriduzione
Anche in questa reazione sono coinvolte delle ossidoriduzioni, però anche questa è facilmente risolvibile a colpo d'occhio.
è bilanciata?
No. L'unico problema in questo caso è l'Ossigeno. Ce ne sono due a sinistra e 6 a destra.
In questo caso è molto semplice. Dato che è solo l'Ossigeno da aggiustare. In più a sinistra è da solo come molecola biatomica e non abbiamo problemi di pari e dispari.
1-Ossigeno (O). Basta aggiungere un 3 davanti all'Ossigeno molecolare
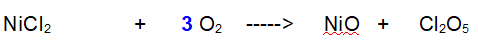
Controlliamo che l'Ossigeno sia corretto. A sinistra ce ne sono 12 + 6; a destra ce ne sono 12 + 6. L'equazione è bilanciata.
QUINDI: Quindi il dicloruro di Nichel reagisce con 3 molecole di Ossigeno per dare Ossido di Nichel e anidride Clorica. (per inciso il Cloro si ossida e l'Ossigeno si riduce, controlliamo i numeri di elettroni scambiati)
Appendice:
Dato che è una reazione redox verifichiamo che il numero di elettroni ceduti dal Cloro (il cui numero di ossidazione passa da -1 a +5) nella reazione bilanciata sia uguale a quello di elettroni ricevuti dall'Ossigeno (il cui numero di ossidazione passa da 0 a -2)
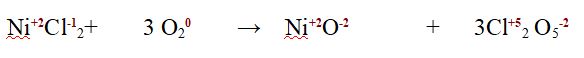
semireazione di ossidazione del Cloro 2 Cl-1 --> 2 Cl+5 + 12 e-
semireazione di riduzione dell'Ossigeno 6 O0 + 12 e- --> 6 O -2
Il numero di elettroni è lo stesso per cui abbiamo verificato che la redox è correttamente bilanciata anche nel numero di elettroni scambiati
Esercizi risolti
Livello medio
Decomposizione dell'acqua ossigenata
“ L'acqua ossigenata si decompone in Acqua e Ossigeno „
Reazione non bilanciata
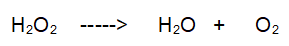
Tipo di reazione: Decomposizione
La terza reazione la conosciamo tutti se abbiamo comprato e conservato male l'acqua ossigenata.
Sia per effetto della luce che del calore l'Acqua Ossigenata si decompone rapidamente in acqua sviluppando Ossigeno.
è bilanciata?
No. A sinistra abbiamo 2 O e a destra 3
è un caso abbastanza semplice. Basta risolvere il problema del pari e dispari degli atomi di Ossigeno.
1 - Ossigeno (O). Raddoppiamo le molecole di Acqua così abbiamo l'Ossigeno pari sia a destra che a sinistra.

2 Idrogeno (H) Raddoppiamo anche le molecole di Acqua Ossigenata in modo da bilanciare contemporaneamente sia Idrogeno che Ossigeno
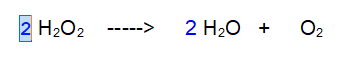
QUINDI: Del resto è abbastanza evidente che per ottenere i due atomi di Ossigeno che servono per formare una molecola di O2 occorrono due molecole di Acqua Ossigenata che ne danno uno a testa
Appendice:
Dato che nelle precendenti abbiamo evidenziato il carattere REDOX delle reazioni è opportuno sottolineare che anche questa è una reazione redox, di un tipo particolare:
Una DISPROPORZIONE
Una reazione in cui uno stesso elemento in parte si ossida e in parte si riduce.
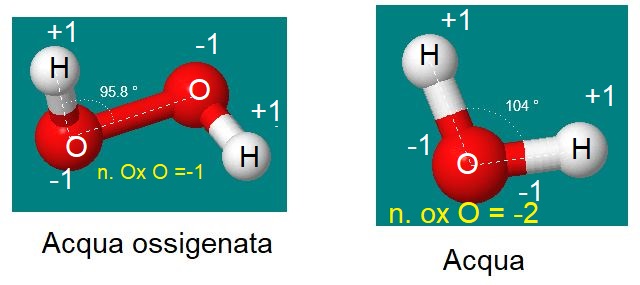
L'ossigeno molecolare ha ovviamente numero di ossidazione 0,
l'Ossigeno dell'acqua ha come di consueto numero di Ossidazione -2,
mentre l'Ossigeno nell'acqua ossigenata ha numero di Ossidazione -1.
Come mai?
Perché l'acqua ossigenata è un PEROSSIDO: un composto in cui DUE atomi di Ossigeno sono legati tra loro. Dato che un legame è formato dagli atomi di Ossigeno, solo un altro legame è disponibile verso un altro elemento. Per cui il numero di Ossidazione è -1.
Argomento precedente: bilanciamento di reazioni livello medio (1)
Argomento successivo bilanciamento di reazioni - livello medio (3)
Il bilanciamento di reazioni chimiche
Bilanciamento delle reazioni chimiche - regole
esercizi svolti sul bilanciamento delle reazioni chimiche (1)
esercizi svolti sul bilanciamento delle reazioni chimiche (2)
esercizi svolti sul bilanciamento delle reazioni chimiche (3)
esercizi svolti sul bilanciamento delle reazioni chimiche (4)
esercizi svolti sul bilanciamento delle reazioni chimiche (5)
esercizi svolti sul bilanciamento delle reazioni chimiche - livello base (1)
esercizi svolti sul bilanciamento delle reazioni chimiche - livello base (2)
Altri argomenti di chimica
Apps e Test
I Legami Chimici - matching matrix
