esercizi svolti sul bilanciamento di reazioni chimiche
inserita 12-12-2020
Esercizi risolti
Livello medio
Nitrato piomboso e cromato di potassio
“ reazione di doppio scambio tra due sali „
Reazione non bilanciata
Tipo di reazione: reazione di doppio scambio
1- La prima reazione da bilanciare è una tipica reazione di doppio scambio tra due sali.
I sali sono formati da ioni positivi (monoatomici o poliatomici) e ioni negativi (monoatomici o poliatomici). Nella reazione di doppio scambio i sali si scambiano gli anioni.
Di seguito l'equazione di reazione con gli ioni separati.
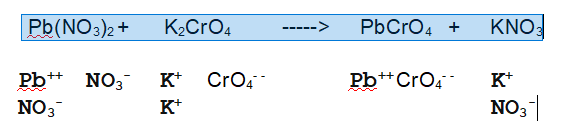
è bilanciata?
No. Vuol dire che i sali non reagiscono in rapporto 1:1:1:1. In questo caso conviene cominciare a bilanciare i metalli.
Le reazioni di doppio scambio tra sali sono facilmente bilanciabili se uno ha occhio per riconoscere gli anioni poliatomici (che non possono essere alterati e vengono trasmessi in blocco). Ma anche se si procede per la via classica non sono per nulla difficili.
1- Potassio (K). A sinistra ce ne sono 2 a destra 1. Mettiamo un 2 davanti al Nitrato di Potassio KNO3.
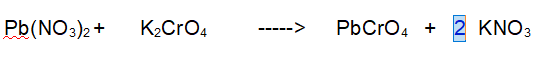
FINITA!
QUINDI: Semplicemente un Nitrato Piomboso scambia i suoi ioni NO3- con gli ioni CrO4-- del cromato di potassio, formando una particella di Cromato Piomboso e 2 particelle di Nitrato di Potassio. (per correttezza essendo composti ionici non posso usare il termine molecola, riservato ai composti covalenti)
Video-esempio con le simulazioni PHET
Link di riferimento:
PHET - Bilanciamento reazioni
PHET - Reagenti, prodotti e residui
Esercizi risolti
Livello medio
Ossidazione del Solfuro di Zinco (II)
“ Si formano Ossido di Zinco (II) e anidride solforosa „
Reazione non bilanciata

Tipo di reazione: Ossidoriduzione
Anche in questa reazione sono coinvolte delle ossidoriduzioni, però anche questa è facilmente risolvibile.
In questo caso lo zolfo viene ossidato dall'Ossigeno
è bilanciata?
No. L'unico problema in questo caso è l'Ossigeno. Ce ne sono due a sinistra e 3 a destra.
Proviamo ad operare solo sull'Ossigeno in quanto è l'unico non bilanciato. Vedremo che questo scombinerà gli altri elementi. L'importante è tenere l'O2 alla fine, l'Ossigeno è da solo e non ci crea problemi con gli altri elementi.
Il primo problema è il pari dispari dell'Ossigeno.
1- Ossigeno (O). Rendiamo pari gli atomi di Ossigeno a destra.
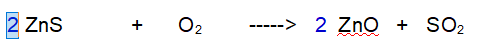
2- Zinco (Zn). Ora dobbiamo risistemare lo Zinco che abbiamo perturbato. Metto 2 davanti al Solfuro di Zinco (II)
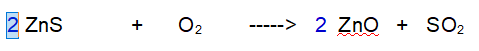
3- Zolfo (S). Ora dobbiamo risistemare lo Zolfo che abbiamo perturbato. Metto 2 davanti all'Anidride Solforosa.
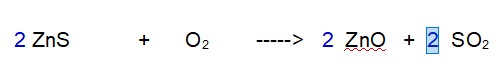
4- Ossigeno (O) di nuovo. Ora dobbiamo risistemare l'Ossigeno. Ce ne sono solo 2 a sinistra e 6 complessivi a destra. Metto 3 come coefficiente stechiometrico davanti all'Ossigeno molecolare.
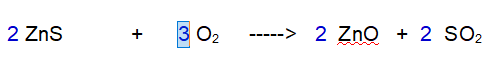
QUINDI: Per ossidare 2 atomi di Zolfo presenti nel Solfuro di Zinco occorrono 3 molecole di Ossigeno Biatomico. Vengono prodotte 2 molecole di Ossido di Zinco e 2 di Anidride Solforosa.
Appendice:
Dato che è una reazione redox verifichiamo che il numero di elettroni ceduti dallo Zolfo (il cui numero di ossidazione passa da -2 a +4) nella reazione bilanciata sia uguale a quello di elettroni ricevuti dall'Ossigeno (il cui numero di ossidazione passa da 0 a -2)
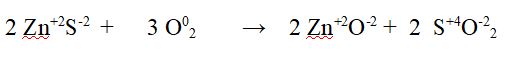
semireazione di ossidazione dello Zolfo 2 S-2 --> 2 S+4 + 12 e-
semireazione di riduzione dell'Ossigeno 6 O0 + 12 e- --> 6 O -2
Il numero di elettroni è lo stesso per cui abbiamo verificato che la redox è correttamente bilanciata anche nel numero di elettroni scambiati
Esercizi risolti
Livello medio
Tetracloruro di Silicio e acqua
“ con formazione di acido silicico e acido cloridrico „
Reazione non bilanciata
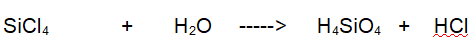
Tipo di reazione: doppio scambio
La terza reazione implica la reazione del tetracloruro di Silicio con acqua per dare due acidi: Acido Silicico e Acido Cloridrico.
è bilanciata?
No. A sinistra abbiamo 4 Cl e a destra 1; 2 H e a destra 5; 1 O e a destra 4;
In questo caso, dato che il Silicio è bilanciato, dobbiamo partire dal Cloro, poi passerei all'Ossigeno e solo alla fine all'Idrogeno che è presente in 3 sostanze diverse.
1 - Cloro (Cl). Ce ne sono 4 a sinistra e 1 a destra. Mettiamo un 4 davanti all'acido cloridrico.

2 - Ossigeno (O). Ce ne sono 4 a destra e uno a sinistra. Occorrono quindi 4 molecole di Acqua.
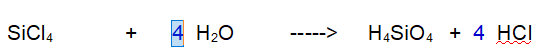
Idrogeno (H). Se contiamo gli atomi ci accorgiamo che è già bilanciato. Ce ne sono 8 a sinistra e 8 a destra. NOn c'è bisogno di fare altro.
QUINDI: Una Molecola di Tetracloruro di Silicio reagisce con 4 molecole di Acqua per dare 1 molecola di Acido Silicico e 4 molecole di Acido Cloridrico.
Argomento precedente: bilanciamento di reazioni livello medio (2)
Argomento successivo bilanciamento di reazioni - livello medio (4)
Il bilanciamento di reazioni chimiche
Bilanciamento delle reazioni chimiche - regole
esercizi svolti sul bilanciamento delle reazioni chimiche (1)
esercizi svolti sul bilanciamento delle reazioni chimiche (2)
esercizi svolti sul bilanciamento delle reazioni chimiche (3)
esercizi svolti sul bilanciamento delle reazioni chimiche (4)
esercizi svolti sul bilanciamento delle reazioni chimiche (5)
esercizi svolti sul bilanciamento delle reazioni chimiche - livello base (1)
esercizi svolti sul bilanciamento delle reazioni chimiche - livello base (2)
Altri argomenti di chimica
Apps e Test
I Legami Chimici - matching matrix
