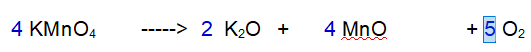esercizi svolti sul bilanciamento di reazioni chimiche
inserita 13-12-2020
Esercizi risolti
Livello base
Decomposizione del clorato di potassio
“ Dalla reazione si forma clorito di potassio e ossigeno „
Reazione non bilanciata
Tipo di reazione: reazione di decomposizione
1- La prima reazione da bilanciare è una tipica decomposizione. Il clorato di Potassio si decompone in Clorito di Potassio e Ossigeno. Di seguito l'equazione di reazione non bilanciata.
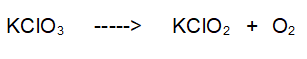
è bilanciata?
No. Abbiamo dei problemi con l'Ossigeno.
Le reazioni di decomposizione sono semplici da bilanciare. In alcuni casi non hanno neanche bisogno di essre bilanciate. Si opera sugli elementi che non sono bilanciati e poi si aggiustano gli altri.
1- Ossigeno (O). Risolviamo il problema pari dispari. Rendiamo pari gli atomi di Ossigeno a sinistra. O2 come al solito lo lasciamo per ultimo.
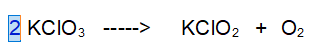
2 - Potassio (e Cloro). Dato che abbiamo deciso che reagiscono 2 "molecole" di Clorato di Potassio si devono per forza formare 2 Molecole di Clorito di Potassio per rispettare il bilanciamento.

FINITA!
QUINDI: Due Particelle di Clorato di Potassio si decompongono in 2 particelle di Clorito di Potassio e una molecola di Ossigeno biatomico (in effetti ognuna perde un atomo di Ossigeno, i 2 atomi si combinano a formare l'Ossigeno biatomico)
Video-esempio con le simulazioni PHET
Link di riferimento:
PHET - Bilanciamento reazioni
PHET - Reagenti, prodotti e residui
Esercizi risolti
Livello medio
Doppio scambio tra bromuro di Gallio e Solfito di Sodio
“ Con formazione di Solfito di Gallio e Bromuro di Sodio „
Reazione non bilanciata
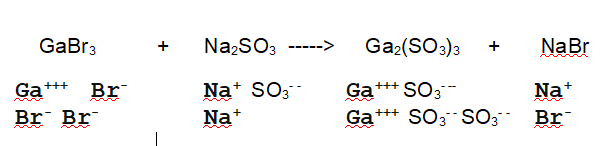
Tipo di reazione: doppio scambio
La reazione da bilanciare è una tipica reazione di doppio scambio tra due sali. I sali sono formati da ioni positivi (monoatomici o poliatomici) e ioni negativi (monoatomici o poliatomici). Nella reazione di doppio scambio i sali si scambiano gli anioni.
In questo caso il Bromuro di Gallio reagisce con il Solfito di Sodio per dare Solfito di Gallio e Bromuro di Sodio
Di seguito l'equazione di reazione con gli ioni separati
è bilanciata?
No. L'equazione non è bilanciata. Vuol dire che i sali non reagiscono in rapporto 1:1:1:1. In questo caso conviene cominciare a bilanciare i metalli.
Le reazioni di doppio scambio sono facilmente bilanciabili se uno ha occhio per riconoscere gli anioni poliatomici (che non possono essere alterati e vengono trasmessi in blocco).
Ma anche se si procede per la via classica non sono per nulla difficili. .
1- Gallio (Ga). Ce n'è 1 a sinistra e 2 a destra. Mettiamo un 2 davanti al Bromuro di Gallio.

2- Bromo (Br). Ora ce ne sono 6 a sinistra e solo 1 a destra. Mettiamo un 6 davanti al Bromuro di Sodio
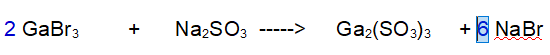
3- Sodio (Na). Ora ne abbiamo 2 a sinistra e 6 a destra. Mettiamo un 3 davanti al Solfito di Sodio
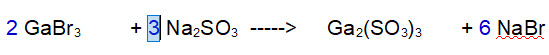
FINITA: Se controlliamo il numero di atomi di Ossigeno e Zolfo sono bilanciati.
QUINDI: 2 Bromuro di Gallio reagiscono con 3 Solfito di Sodio per dare 1 Solfito di Gallio e 6 Bromuro di Sodio.
Esercizi risolti
Livello medio
Decomposizione del permanganato di Potassio
“ con formazione di Ossido di Potassio, Ossido di Manganese e Ossigeno „
Reazione non bilanciata
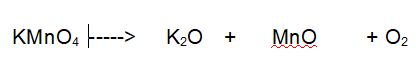
Tipo di reazione: decomposizione
La terza reazione è una decomposizione. Il Permanganato di Potassio si decompone in Ossido di Potassio, Ossido di Manganese e Ossigeno molecolare.
è bilanciata?
No. Il Potassio non è bilanciato. 1 a destra e 2 a sinistra.
Cominciamo ad aggiustare il Potassio (K)
1 - Potassio (K). Siccome ci sono due atomi di potassio nell'ossido devono reagire due particelle di Permanganato di Potassio.
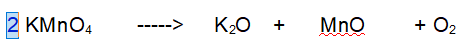
2 - Manganese (Mn). Ora abbiamo due atomi di Manganese a sinistra per cui ce ne devono essere 2 a destra.
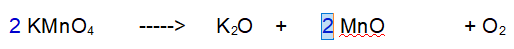
3 - Ossigeno (O). Ne abbiamo 8 a sinistra e 5 a destra. Raddoppiamo tutto tranne l'Ossigeno.
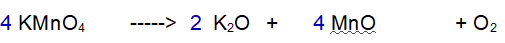
4 - Ossigeno (O). Ora ne abbiamo 16 a sinistra e 8 a destra. Occorrono 5 molecole di Ossigeno totali per bilanciare la reazione.