I Calcoli Stechiometrici
inserita 11-04-2020
Elementi Fondamentali
Reazione chimica e equazione di reazione
“ La reazione chimica „
Nel corso di una reazione chimica una o più sostanze (elementi o composti) si trasformano in uno o più prodotti (elementi o composti)
Per convenzione le sostanze presenti all'inizio della reazione i REAGENTI si scrivono a sinistra e quelle presenti al termine della reazione i PRODOTTI si scrivono a destra.
I due gruppi sono separati da una freccia che indica la DIREZIONE della reazione.
reagenti -----> prodotti
PRIMA TAPPA:
La prima tappa della stesura di una equazione di reazione è quindi identificare tutti i reagenti e prodotti coinvolti. (vedi esempio seguente)
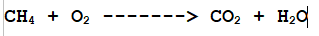
In questa reazione, la combustione del Metano (ossidazione ad opera dell'Ossigeno con grande sviluppo di calore) produce anidride carbonica e acqua.
SECONDA TAPPA:
Nell'equazione precedente ci rendiamo conto che qualcosa non va. Stiamo operando nell'ambito della chimica in cui gli atomi possono legarsi gli uni agli altri o separarsi SOLO mettendo in gioco i propri elettroni.
Per cui atomi di un elemento non possono trasformarsi in atomi di un altro elemento, né possono apparire o scomparire a piacimento.
Vale quindi la regola fondamentale delle reazioni chimiche.
Il numero di atomi di ogni elemento presenti all'inizio della reazione deve essere uguale al numero degli atomi dello stesso elemento presenti alla fine della reazione
L'equazione sopra non è quindi completamente veritiera. A sinistra abbiamo 4 atomi di idrogeno e a destra 2; a sinistra abbiamo 2 atomi di ossigeno a destra 3.
Cosa significa?
Significa che le quattro sostanze non reagiscono tra loro in un semplice rapporto numerico 1,1,1,1
Occorre quindi stabilire il loro reale rapporto numerico di reazione. E questo si fa attraverso il
Bilanciamento di una reazione chimica
“ Il bilanciamento di una reazione chimica „
Dobbiamo trovare il reale rapporto numerico di interazione delle sostanze nella reazione.
Dobbiamo attribuire dei numeri, che scriviamo a sinistra della formula chimica di ogni sostanza (1 non si scrive per convenzione) che diano l'informazione di quante molecole della sostanza sono impegnate nella reazione.
Andiamo per tentativi:
1- Il carbonio è già bilanciato 1 a sinistra ----> 1 a destra
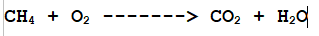
2- L'idrogeno no. Ce ne sono 4 a sinistra e 2 a destra. Vorrà dire che per ogni molecola di metano che reagisce se ne formano 2 di acqua.
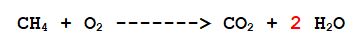
3- L'Ossigeno: ce ne sono 2 a sinistra e 4 in totale a destra (2 nella molecola di anidride carbonica e 2 nelle due molecole di acqua) Sistemiamolo.
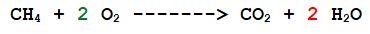
Ora abbiamo il corretto rapporto numerico di reazione delle molecole.
1 molecola di metano reagisce con 2 molecole di ossigeno per dare 1 molecola di anidride carbonica e 2 molecole di acqua.
I numeri interi che indicano il numero di molecole che intervengono nella reazione si chiamano COEFFICIENTI STECHIOMETRICI.
Stechiometria e Calcoli Stechiometrici
“ Dai calcoli dei coefficienti alla pratica di laboratorio: La Mole „
Una volta effettuato correttamente il bilanciamento dell'equazione ci troviamo di fronte a un problema pratico.
In laboratorio (chimico, farmacologico o qualsivoglia altro laboratorio) quando mettiamo a reagire delle sostanze per ottenere dei prodotti non possiamo ovviamente metterci a contarle una ad una.
Quello che in genere ci interessa è ottenere una certa quantità in massa di un prodotto a partire da una certa quantità di reagenti.
Occorre quindi mettere in relazione il numero delle molecole con la loro massa effettiva.
Abbiamo ideato a questo proposito una GRANDEZZA FONDAMENTALE che ci permette di ricavare la quantità in grammi di una sostanza associata a un numero definito di molecole di quella sostanza.
LA MOLE (n)
Ogni sostanza ha la sua massa molare che corrisponde numericamente a una quantità in grammi della sostanza pari alla somma delle masse atomiche di tutti gli atomi che la compongono.
Come facciamo a conoscere le masse atomiche dei singoli elementi?
Semplicemente qualcun altro le ha calcolate per noi e le troviamo nella tavola periodica.
Per l'Idrogeno il Carbonio e l'Ossigeno dalla tavola periodica leggiamo:
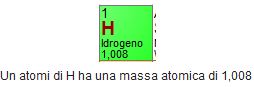


- Quindi la massa molecolare (approssimata) del metano è 1 C + 4 H = 16 u.m.a
- Quindi la massa molecolare (approssimata) dell'Ossigeno molecolare 2 O = 32 u.m.a
- Quindi la massa molecolare (approssimata) dell'anidride carbonica è 1 C + 2 O = 44 u.m.a
- Quindi la massa molecolare (approssimata) dell'acqua è 1 O + 2 H = 18 u.m.a
Cosa vuol dire questo?
Che se prendo 16 grammi di metano, 32 grammi di ossigeno molecolare, 44 grammi di Anidride carbonica e 18 grammi di acqua prenderò lo stesso numero di molecole di ogni sostanza.
Questo numero puro corrisponde a una mole di sostanza che contiene un numero di molecole sempre uguale:un numero di Avogadro di molecole, 6,02 x10 alla 23 molecole.
UN NUMERO ENORME!!!
Matematicamente possiamo schematizzare che, per definizione della mole:
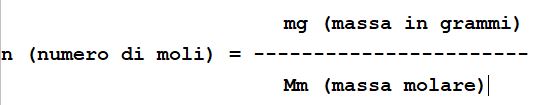
16 grammi di metano è una mole di metano
8 grammi di metano è mezza mole di metano (e così via)
Schematizzare un calcolo stechiometrico
Ora abbiamo una grandezza operativa, la mole,
che ci permette facilmente di mettere in correlazione una quantità in grammi di una sostanza, quella che praticamente pesiamo in laboratorio,
con il numero delle molecole,
quelle rappresentate nell'equazione di reazione.
I Calcoli Stechiometrici servono proprio a conoscere la quantità di prodotti di una reazione partendo da una determinata quantità di reagenti.
La procedura è molto semplice:
Voglio sapere quanta anidride carbonica viene prodotta se brucio 100 grammi di metano?
Procedo in questo modo:
1- determino con la formula precedente a quante moli corrispondono 100 grammi di metano. n=100 g/16 g-mole = 6,25 moli
2- I coefficienti stechiometrici mi dicono che per ogni molecola di metano si forma una molecola di anidride carbonica. Per cui da 6,25 moli di metano si formeranno 6,25 moli di anidride carbonica.
3- Utilizzo nuovamente la formula della mole per ricavarmi a quanti grammi di anidride carbonica corrispondono 6,25 moli della stessa. mg=n . Mm = 6,25 mol . 44 g/mol = 275 grammi
Per cui se metto a reagire 100 grammi di metano si formano 275 grammi di anidride carbonica.
Questo perché l'anidride carbonica ha una massa 2,75 volte maggiore di quella del metano. (16x2,75=44)
Stechiometria e Calcoli Stechiometrici
“ impostare una tabella per i calcoli stechiometrici „
Tutti questi calcoli possono essere incasellati in una tabella ordinata che ci facilita di molto la risoluzione senza possibilità di errore nella gestione delle formule.
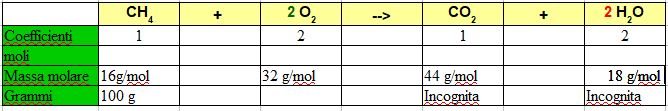
- Se conosco i grammi di una sostanza e voglio conoscere le moli divido per la massa molare in colonna.
- se conosco le moli di una sostanza e voglio conoscere i grammi moltiplico per la massa molare in colonna
- Nel caso i coefficienti stechiometrici siano diversi effettuo una semplice proporzione in colonna.
Nel caso in esempio:
Mettiamo che voglio sapere quanti grammi di ossigeno sono necessari per bruciare 100 grammi di metano.
6,25 moli di metano : 1 (coefficiente) = X (moli di ossigeno) : 2 (coefficiente)
per cui X = 6,25 . 2 / 1 = 12,5 moli di ossigeno
12,5. 32 g/mol = 400 grammi di ossigeno
Quindi per bruciare 100 grammi di metano occorrono ben 400 grammi di ossigeno.
(per ogni molecola di metano ce ne vogliono 2 di Ossigeno molecolare e l'Ossigeno molecolare ha una massa 2 volte più grande di quella del Metano)
La prossima lezione prenderà in esame il concetto di reagente limitante e reagente in eccesso di una reazione.
