la resa di reazione
inserita 08-05-2020
la resa di reazione
elementi fondamentali
“ Quasi mai le cose vanno come previsto dalla teoria „
Nei post precedenti abbiamo imparato a risolvere un calcolo stechiometrico di base e il problema del Reagente Limitante.
Con i calcoli della tabella possiamo stabilire con estrema precisione quanto prodotto si forma a partire da una determinata quantità di reagenti.
Ma questo solo dal punto di vista Teorico.
Quando andiamo ad effettuare la reazione in laboratorio, non importa quanto precisi possiamo essere e con quanta diligenza seguiamo il protocollo di reazione, impostando tutti i parametri correttamente, adottando tutti gli accorgimenti per agevolare la reazione, accade qualcosa di frustrante:
La quantità di prodotto ottenuta è sempre MINORE di quella attesa dai nostri calcoli.
Perché accade una cosa del genere?
Per una serie di motivi.
0- La prima legge di Murphy
Se qualcosa può andar male, lo farà (scherzo)
1- L'ambiente di reazione prevede dei parametri fisici, soprattutto Temperatura e Pressione, precisi.
In realtà durante la reazione e nelle diverse zone del recipiente questi parametri possono fluttuare.
2-Assumiamo che TUTTE le molecole di TUTTI i reagenti abbiano la stessa possibilità di incontrarsi per reagire.
Una situazione utopica e irrealizzabile (se abbiamo in reazione dei gas è più facile che ci si possa avvicinare ma quando facciamo reagire granuli o polveri solide è molto più difficile.
3-Ma soprattutto tutte le reazioni avvengono attraverso una SERIE DI PASSAGGI con la formazione di NUMEROSI INTERMEDI DI REAZIONE.
In ognuno di questi passaggi i reagenti e gli intermedi possono scegliere strade diverse e produrre composti indesiderati che sono SOTTRATTI alla resa finale della reazione e magari la ostacolano o la sfavoriscono.
Ad esempio nelle reazioni di combustione degli idrocarburi noi assumiamo che i prodotti della reazione siano esclusivamente Acqua e Anidride Carbonica.
In realtà, per quanto io possa assicurare una soddisfacente circolazione dell'Ossigeno, una certa percentuale della combustione mi produce sempre non Anidride Carbonica, ma Monossido di Carbonio, diminuendo la RESA FINALE che mi aspettavo dalla reazione.
Il problema della formazione di Monossido di Carbonio è sempre implicito nel funzionamento ad esempio delle caldaie a gas, anche quelle usate nel riscaldamento domestico.
Se la manuntezione di una caldaia non è stata effettuata, se non si controllano i fumi emessi dalla caldaia, nel corso del tempo la caldaia diventa sempre meno efficiente e la deriva della combustione verso la produzione di Monossido di Carbonio diventa sempre più importante. E il Monossido di Carbonio è un gas TOSSICO che avvelena l'emoglobina dei nostri globuli rossi.
Per cui le reazioni chimiche, soprattutto quelle industriali, vanno costantemente monitorate, per controllare l'andamento della reazione.
Fermo restando che la NOSTRA RESA sarà sempre minore rispetto a quella che posso calcolare con i semplici calcoli stechiometrici.
A questo punto, per affrontare la realtà di una reazione chimica che passa dai calcoli a tavolino alla sua effettiva messa in produzione introduciamo 3 grandezze che possono aiutarci a determinare la VERA quantità di prodotto che posso ottenere quando metto a reagire alcune sostanze.
RESA TEORICA (RT):
è la Quantità di prodotto che mi aspetto effettuando i calcoli stechiometrici e considerando il problema del reagente limitante.
RESA EFFETTIVA (RE):
è la Quantità di prodotto che misuro, pesandolo o con altri metodi, alla fine della reazione.
Come abbiamo detto è SEMPRE MINORE di quella che mi aspettavo.
RESA PERCENTUALE (RP):
è il rapporto tra Resa effettiva e Resa teorica moltiplicato per cento, espressa in percentuale
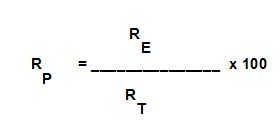
Quindi, quando si progetta una reazione, soprattutto in campo industriale, occorre considerare sempre quale sarà la mia RP.
Se è l'80%, è un'ottima resa di reazione, se è il 20%, sprecherò un sacco di materiale (ma in alcuni casi se è l'unico modo possibile per ottenere un prodotto va portata avanti comunque, fino a quando non si idea un percorso di reazione più efficiente.
RISOLUZIONE DI PROBLEMI CON RESA TEORICA, EFFETTIVA E PERCENTUALE
“ Risolviamo i problemi sempre con la tabella ma abbiamo bisogno di un passaggio aggiuntivo „
Nella risoluzione di questi tipi di problemi la cosa fondamentale da tenere a mente è che devo TENER CONTO di un passaggio aggiuntivo:
Il confronto tra le due rese, quella calcolata a tavolino e quella effettivamente misurata nella realtà
Prima di tutto bilanciamo la reazione
Per cui, per i calcoli della resa teorica procedo normalmente con il metodo della tabella spiegato nei due post calcolo stechiometrico di base e il Reagente Limitante.
e poi confronto la mia Resa Teorica con quella misurata (in realtà nella maggior parte dei problemi vi viene dato sempre il dato della RESA PERCENTUALE e quindi da quello dovete ricavare la resa effettiva)
Per cui basta utilizzare la formula illustrata sopra in un passaggio aggiuntivo, che può essere all'inizio o alla fine a seconda di come è posto il problema
PROBLEMA RISOLTO SULLA RESA TEORICA, EFFETTIVA E PERCENTUALE
Il Solfuro di Carbonio (IV) e il Diossido di Carbonio sono prodotti del Carbonio con il diossido di Zolfo.
Calcola quanti chilogrammi di carbonio sono necessari per produrre 1 Kg di CS2 sapendo che la resa percentuale è del 90%
Prima di tutto impostiamo la reazione
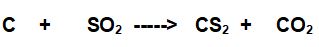
Bilanciamola
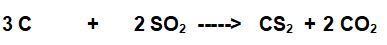
Ora che cosa sappiamo?
Sappiamo che la nostra resa percentuale è del 90% e so quanto Solfuro di Carbonio (IV) voglio ottenere, cioè la resa effettiva
Per cui il primo passo è calcolarmi la resa teorica.
RT= (RE/RP)*100 ----> RT= (1000g/90)*100 = 1111,1 grammi
Cosa vuol dire?
Vuol dire che se io, alla fine, voglio ottenere 1000 grammi di Solfuro di Carbonio (IV) devo mettere a reagire tanto carbonio quanto me ne occorrerebbe teoricamente per ottenere 1111,1 grammi, in quanto il 10% di quello che metto a reagire va praticamente perso.
A questo punto imposto la classica tabella e mi calcolo il Carbonio necessario con i passaggi che già conoscete. (vedi post calcolo stechiometrico di base e il Reagente Limitante.)

Quindi devo mettere a reagire 525, 34 grammi di Carbonio per ottenere 1000 grammi di CS2 in quanto la reazione ha una resa percentuale del 90% e il 10% del prodotto non si forma.
Se la resa fosse stata del 100%, situazione irrealizzabile praticamente, avrei avuto:
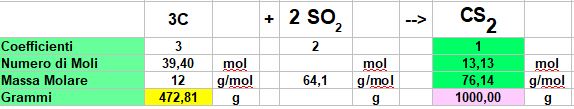
Quindi in una situazione ideale mi sarebbero bastati 472,81 grammi di Carbonio per ottenere 1 Kg di Solfuro di Carbonio (IV) o disolfuro di carbonio.
