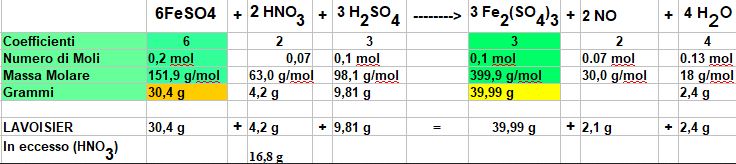Problemi Risolti
inserita 08-05-2020
Reagente limitante
problema 1
“ Esempi di problemi risolti di calcoli stechiometrici „
In base alla procedura descritta nel post Reagente Limitante e Reagente in Eccesso.
Risolviamo il seguente problema
PROBLEMA: Calcola quanti grammi di Solfato Ferrico si possono ottenere da 30,4 g di Solfato Ferroso che reagisce con 21 grammi di acido Nitrico puro secondo la reazione:
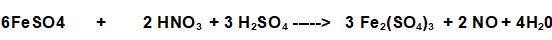
Impostiamo la tabella e calcoliamo il numero di moli dei reagenti:

Calcoliamo le moli di Solfato Ferroso e Acido Nitrico disponibili

Abbiamo 0, 2 moli di Solfato ferroso e 0,33 moli di Acido Nitrico.
Si vede a occhio che il Solfato Ferroso è il REAGENTE LIMITANTE, non solo perché il numero di moli è minore ma soprattutto perché il rapporto stechiometrico è 6:2, per cui occorrerebbero 3 volte le moli di Solfato Ferroso per reagire con tutto l'acido Nitrico.
Verifichiamolo comunque con una proporzione.
X : 6 = 0,33 : 2 ------> X (numeri di moli di Solfato Ferroso che occorrerebbero) = 0,33x6/2 = 0,99 moli.
Noi ne abbiamo solo 0,2 per cui il Solfato Ferroso è il REAGENTE LIMITANTE e sarà quello che deciderà l'arresto della reazione
SECONDO PASSAGGIO:
Ora posso calcolare quanto Solfato Ferrico si è formato una volta consumato tutto il Solfato Ferroso.
Prima di tutto calcoliamo le moli di Solfato Ferrico.
0,2:6 = X:3 -----> X (moli di Solfato Ferrico) = 0,2 (moli di solfato ferroso) x 3 (coefficiente del Solfato Ferrico) / 6 (coefficiente del Solfato ferroso) = 0,1 moli
Ora con la tabella calcoliamo i grammi di Solfato Ferrico che si è formato
0,1 mol x 399,9 g/mol = 39,99 grammi
come spiegato nel post precedente
è il rapporto tra Resa effettiva e Resa teorica moltiplicato per cento, espressa in percentuale

A questo punto posso anche calcolare quanto Acido Nitrico mi è rimasto nel recipiente IN ECCESSO
Le moli di Acido Nitrico hanno reagito in base alla seguente proporzione
0,2 moli di Solfato Ferroso : 6 = X (moli di Acido Nitrico che hanno reagito) : 2
X= 0,2 x 2/ 6 = 0,07 moli
= 0,07 moli di Acido Nitrico pari a 0,07 x 63 = 4,2 grammi
per cui mi restano 21 g - 4,2 g = 16,8 grammi di Acido Nitrico che non hanno reagito
Posso controllare con la legge di Lavoisier (massa dei reagenti = massa dei prodotti) il risultato.