Problemi Risolti
inserita 09-05-2020
Reagente limitante
problema 3
“ Esempi di problemi risolti di calcoli stechiometrici „
In base alla procedura descritta nel post Reagente Limitante e Reagente in Eccesso.
Risolviamo il seguente problema
PROBLEMA: 12 grammi di Cloruro di Bario vengono disciolti in acqua e trattati con una soluzione di Acido Solforico fino alla completa precipitazione di Solfato di Bario, secondo la reazione riportata sotto (già bilanciata e con gli ioni in evidenza). :
1- Calcola la massa di Solfato di Bario che si forma dalla reazione
2- Se si disponesse di 12 mL di una soluzione di Acido Solforico 0,10 M la reazione sarebbe completa?
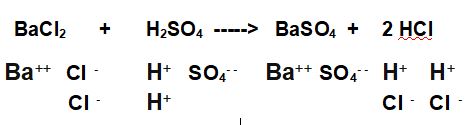
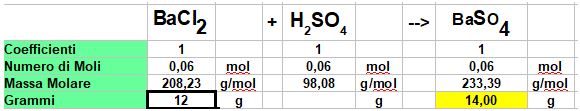
Punto 1 Soluzione - Non ci sono limitazioni per cui dobbiamo semplicemente usare la tabella per calcolare quanto Solfato di Bario si forma
Punto 2 Soluzione - Dobbiamo verificare se le moli contenute in 12 mL della soluzione sono sufficienti per precipitare tutto il Solfato di Bario oppure no.
Punto 1: Impostiamo la tabella(vedi i post sul calcolo stechiometrico per la procedura)

Calcoliamo le moli di Cloruro di Bario

Il rapporto di Coefficienti è 1:1 per cui si formano 0,06 moli di Solfato di Bario e occorrono per completare la reazione 0,06 moli di Acido Solforico (ci servirà per il punto 2)

Ora Calcoliamo a quanti grammi corrispondo 0,06 moli di Solfato di Bario.
0,06 x 233, 39 = 14 grammi
Punto 2: verifichiamo quante moli di Acido Solforico ci sono nella soluzione
Per completare la reazione ci vogliono 0,06 moli di Acido Solforico.
Dobbiamo verificare se in 12 mL di una Soluzione 0,10 M ci sono almento 0,06 moli.
Noi sappiamo che la Molarità è rappresentata dalla seguente formula
M = n (numero di moli)/V(volume espresso in Litri)
Per cui: 12 mL è equivalente a 0,012 L
ne discende che il numero di moli contenuti in 12 mL di una soluzione 0,10 M è:
n=0,1*0,012= 0,0012 moli
Per cui possiamo affermare che L'acido Solforico è il REAGENTE LIMITANTE e NON riesce a consumare tutto il Cloruro di Bario! Per cui la risposta al punto 2 è LA REAZIONE NON è COMPLETA.
