Problemi Risolti
inserita 09-05-2020
Resa di Reazione
problema 1
“ Esempi di problemi risolti di resa di reazione „
La teoria sulla resa di reazione e sulla risoluzione dei problemi la trovate in questo post Calcoli Stechiometrici - la resa di reazione..
Risolviamo il seguente problema
PROBLEMA: Data la seguente reazione da bilanciare:
25 grammi di Alluminio reagiscono con 100 grammi di Bromo formando 64,2 grammi di bromuro di alluminio.
Qual è la resa percentuale della reazione?
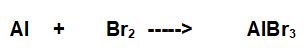
Dal post precedente Reazioni di sintesi (1) sappiamo che questa è una semplice reazione di sintesi di un sale binario facile da bilanciare.
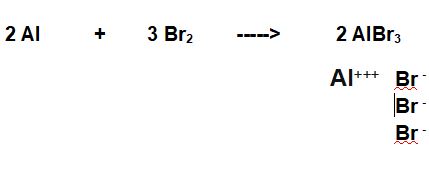
(l'alluminio sta al III gruppo e cede in blocco i suoi 3 elettroni di valenza, il Bromo necessita di un solo elettrone per cui il sale che si forma, il bromuro di alluminio ha i 2 elementi in rapporto di 1:3.
TAPPA 1 BILANCIAMO:
TAPPA 2 - verifichiamo se c'è un reagente limitante:
L'esercizio ci dà quantità definite di Alluminio e Bromo. Dobbiamo capire quale dei due è il Reagente Limitante.
Impostiamo la tabella e vediamo quale dei due è il reagente limitante. Calcoliamo le moli di ognuno.

Dal rapporto 2:3 tra Alluminio e Bromo si evince, fatte salve le approssimazioni inevitabili, che i due composti sono bilanciati correttamente.
Possiamo quindi trascurare il problema del reagente limitante con un'approssimazione accettabile e concentrarci solo sul problema della Resa di reazione.
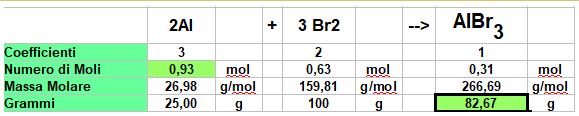
Usiamo i dati dell'Alluminio per calcolare la massa del prodotto.
PROPORZIONE DI VERIFICA: 0,93:3=X:2 ---> X (moli di Bromo necessarie)= 0.93*2/3= 0,62
TAPPA 3 - CALCOLIAMO LA RESA TEORICA:
Usiamo la tabella come al solito vedi IL POST SUI CALCOLI STECHIOMETRICI
TAPPA 4 - CONFRONTIAMO RESA TEORICA E RESA EFFETTIVA:
Il testo dell'esercizio ci informa che abbiamo ottenuto dalla reazione
64,2 grammi di prodotto - questa è ovviamente la resa effettiva RE
Noi abbiamo calcolato che la resa teorica RT che avremmo dovuto ottenere da quelle quantità di partenza è 82,67 grammi.
Usiamo la formula
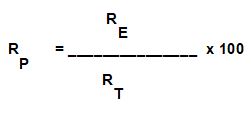
Per calcolare la Resa Percentuale
RP=(64,2/82,67)*100 ---> 78%
Quindi la mia reazione ha una resa percentuale del 78%
