Molalità di una soluzione
Definizione di molalità come concentrazione di una soluzione
inserita il 18-03-2023
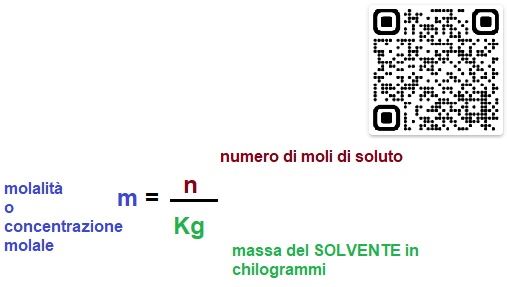
La formula della molalità
“ La molalità esprime il numero di moli di soluto in un Kg di solvente „
In altre pagine abbiamo definito l'unità di misura della concentrazione più utilizzata in laboratorio chimico: La Molarità.
E abbiamo risolto alcuni semplici esercizi di calcolo della concentrazione molare di una soluzione.
Per la definizione di numero di moli e concentrazione vi rimando alle pagine su indicate. In questa pagina definiamo la seconda unità di misura di concentrazione di uso pratico nei laboratori di chimica e oggetto di studio nel programma delle superiori.
RICORDA: Cosa vuol dire determinare la concentrazione?
Calcolare la quantità di soluto, in grammi, in numero di particelle o in moli, sciolta in un volume o in una quantità di soluzione. Di modo che se io prelevo una certa quantità di soluzione so con precisione quanto soluto è contenuto nel mio campione. Mentre nel caso della molarità abbiamo considerato il VOLUME della soluzione, nel caso della molalità consideriamo come riferimento la MASSA del SOLVENTE espressa in Kg.
m=n/Kg (solvente)
La differenza tra molalità e molarità
Le definizioni di Molarità e molalità sono quindi molto simili.
Entrambe prendono in considerazione la quantità di soluto espressa in moli. Abbiamo spiegato nelle pagine precedenti che la mole, o quantità di sostanza, è un'unità molto comoda in quanto ci permette di confrontare direttamente il numero di particelle, molecole, atomi o ioni, in gioco, cosa indispensabile quando operiamo nell'ambito delle reazioni chimiche, in quanto le reazioni si basano sul numero di molecole o atomi che reagiscono e non direttamente sulla loro massa.
Però c'è una differenza al denominatore della frazione.
Per la molarità dividiamo (distribuiamo) il numero di moli di soluto in unLITRI di SOLUZIONE, VOLUME
Per la molalità dividiamo (distribuiamo) il numero di moli di soluto in CHILOGRAMMI di SOLVENTE MASSA
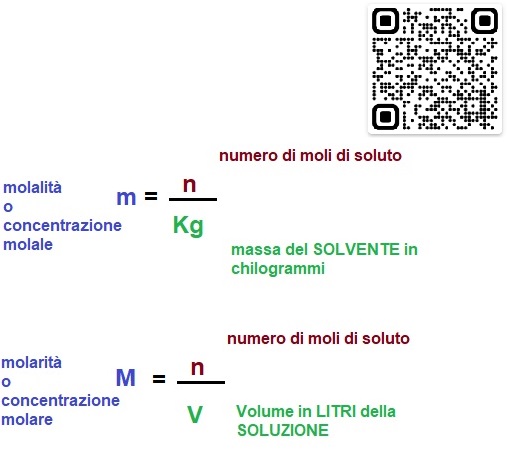
Confrontiamo molalità e molarità
A questo punto viene spontaneo chiedersi il perché di DUE misure di concentrazione basati sul numero di moli. La risposta è come sempre per una questione pratica.
La legge fondamentale dalla quale è nata la chimica moderna e la legge di Conservazione della Massa di Lavoisier:
La massa delle sostanze prodotte in una reazione chimica è uguale alla massa delle sostanze reagenti
La massa in chimica non varia anche se variano le condizioni di pressione e temperatura dell'ambiente di reazione!
In base a questa premessa l'unità di concentrazione più affidabile tra le due è sicuramente la molalità.
Se io ho una soluzione 0,3 molale di una qualsiasi sostanza in un qualsiasi solvente so per certo che avrò 0,3 moli di soluto per chilo di solvente qualsiasi siano le condizioni di Temperatura e Pressione.
La massa quindi non varia... Ma il volume?
Il Volume di una soluzione, soprattutto se in fase liquida e ancor peggio se in fase aeriforme, risente delle condizioni di Temperatura e Pressione, in quanto tali variazioni possono alterare la densità del solvente e di conseguenza della soluzione intera.
La densità è definita come il rapporto tra la quantità di massa e il volume occupato dalla sostanza o miscela in considerazione e viene espressa in genere g/cm3 o Kg/L nell'uso comune anche se l'unità di misura dovrebbe essere Kg/m3
Il valore della densità non resta costante se variano le condizioni ambientali di Temperatura e Pressione. Di conseguenza il valore della MOLARITA' cambia se cambiano le condizioni di Temperatura e Pressione;
Invece il valore della MOLALITA', che si basa in definitiva su un rapporto di MASSE (anche se quella del soluto è espressa in numero di moli e non in grammi) non varia se cambiano tali condizioni.
Perchè le variazioni di Temperatura o la pressione possono far variare la densità?
La densità di una precisa sostanza o miscela a livello microscopico dipende da quanto le singole particelle di un solido, liquido o aeriforme, si avvicinino o si allontanino fra loro occupando quindi un volume minore o maggiore.
Un aumento di temperatura tende di norma a far diminuire la densità di un corpo in quanto le particelle acquisiscono maggior energia cinetica che consente loro di superare le forze intermolecolari di adesione e di allontanarsi.
Un aumento di Pressione costringe invece le particelle ad avvicinarsi e occupare un volume minore.
Quindi il volume di una sostanza o di una soluzione è dipendente dalle condizioni di pressione e temperatura nell'ambiente di lavoro in quanto la densità varia ma la massa totale resta costante. (guarda la figura sotto)
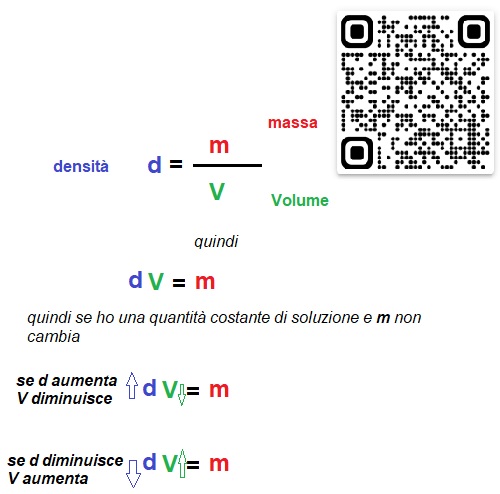
Per cui se io preparo una soluzione 0,3 molare in determinate condizioni di temperatura e pressione, mi devo aspettare che, se cambiano le condizioni di temperatura e pressione, mi cambi anche la concentrazione della soluzione in quanto il volume può aumentare o diminuire.
Per cui la molarità è meno affidabile rispetto alla molalità.
Perché in laboratorio si usa più la molarità che la molalità
In base alle premesse che abbiamo fatto sarebbe logico usare solo la molalità; eppure di norma in una laboratorio chimico si usa preferenzialmente la molarità e più raramente la molalità
Perché?
La risposta è sempre la stessa: per una questione di praticità
- In laboratorio usiamo prevalentemente soluzioni in fase liquida e operiamo prelevando o aggiungendo volumi di soluzione o di solvente. E la molarità tiene conto del VOLUME di una soluzione. Sarebbe meno pratico usare la molalità che invece tiene conto della MASSA del solvente (e quindi dovrei utilizzare continuamente la bilancia di precisione).
- Possiamo farlo? Sì possiamo farlo in quanto in un laboratorio chimico o biologico le condizioni di Temperatura e Pressione non variano apprezzabilmente: di conseguenza il volume della soluzione che ho preparato e che uso non varia e con esso non varia la MOLARITA' della soluzione.
- Consideriamo poi che le soluzioni che usiamo sono in genere in fase acquosa, per cui il solvente è l'acqua.
La densità dell'acqua non varia molto entro limitate variazioni di Temperatura:
la densità dell'acqua ha un massimo a 4°C di temperatura alla quale è circa 1 Kg/L;
a 20°C è di 0,998
e a 25°C è di 0,997 Kg/L;
in genere la temperatura all'interno dei laboratori è attorno ai 20 °C e, anche se conserviamo alcune soluzioni in frigorifero a 4 °C raggiungono abbastanza rapidamente la temperatura ambiente.
Anche se non dovessimo aspettare la variazione sarebbe comunque del 2 per mille.
Altri solventi, come ad esempio l'acetone, presentano variazioni più consistenti e non trascurabili.
Quando uso la molalità?
In tutte le condizioni in cui invece nell'ambiente di lavoro ci sono grandi variazioni di temperatura, pressione e volatilità del solvente DEVO invece usare la molalità che, come abbiamo detto sopra, resta comunque COSTANTE. Se usassi la molarità incorrerei in errori di misura non trascurabili.
Come passare dalla molarità alla molalità
Per passare dalla molarità alla molalità e viceversa, esercizi che spesso gli studenti devono risolvere nel corso degli studi, non mi bastano solo le formule risolutive delle due grandezze.
Devo ovviamente conoscere anche la Densità della Soluzione, in modo da confrontare tra loro la Massa, per la molalità e il Volume, per la molarità della soluzione.
Nelle pagine successive vedremo prima degli esercizi base sulla molalità e poi come passare dall'una all'altra unità di concentrazione.
Pagina precedente -esercizi svolti sulla molarità (2)
Pagina successiva - esercizi svolti sulla molalità (1)
Concentrazioni delle soluzioni chimiche
Calcolo della Molarità, delle moli e Numero di Avogadro - teoria e calcolatore online
molalità e concentrazione molale
esercizi svolti sulla molarità (1)
esercizi svolti sulla molarità (2)
esercizi svolti sulla molalità (1)
esercizi svolti sulla molalità (2)
esercizi svolti sulla molalità (3)
esercizi svolti da molarità a molalità
esercizi svolti da molalità a molarità
Le concentrazioni percentuali m/m esercizi svolti (1)
Le concentrazioni percentuali m/V esercizi svolti (2)
Le concentrazioni percentuali V/V esercizi svolti (3)
Altri argomenti di chimica
Il bilanciamento di reazioni chimiche
Altri convertitori
Calcolo della Molarità, delle moli e Numero di Avogadro - teoria e calcolatore online
tabelle
tabelle riassuntive su Mercurio
tabelle riassuntive su Plutone
Apps e Test
