tipi di reazioni chimiche
inserita 01-02-2021
Le reazioni di sintesi che coinvolgono l'Ossigeno
2- Formazione degli ossidi basici o metallici
“ Per la parte introduttiva sulle reazione di sintesi e le reazioni di sintesi dei sali binari consultate il post: reazioni di sintesi (1) „
NB: L'Ossigeno e l'idrogeno sono gli elementi più reattivi e versatili del sistema periodico. Per cui vengono presi in considerazione autonomamente e formano classi di composti propri.
Schema di Reazione
Metallo + Ossigeno ----> Ossido Basico
L'Ossigeno può combinarsi agevolmente con la maggior parte dei metalli, tranne i metalli nobili che sono molto resistenti alla ossidazione, ad esempio palladio, platino e oro.
I rapporti molari dipendono dalle condizioni di reazione e dal numero di elettroni che il metallo può mettere in gioco, vedi post: reazioni di sintesi (1)
Prendiamo ad esempio la reazione tra Ossigeno e Rame.
Abbiamo due possibilità in quanto il Rame mette in gioco facilmente 1 o 2 elettroni.
Nel primo caso otterremo l'ossido rameoso e nel secondo l'ossido rameico.
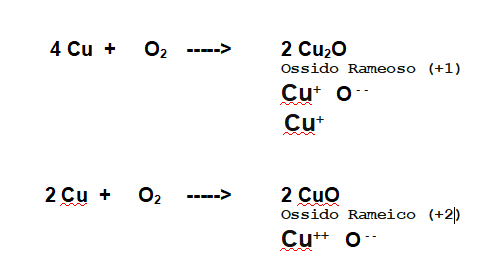
Si tratta di reazioni di ossidoriduzioni in quanto il Rame cede 1 o 2 elettroni all'Ossigeno, mentre l'Ossigeno passa dallo stato di ossidazione 0 a -2. I composti che si formano sono in generale IONICI.
I metalli presenti nei minerali sono quasi sempre in forma ossidata e spesso legati all'Ossigeno. Per ottenerli in forma pura occorre restituire a quei metalli gli elettroni persi durante l'ossidazione in un processo chiamato riduzione.
Puoi guardare Questo Video sull'estrazione del rame tramite riduzione con Idrogeno.
3- Formazione degli Idrossidi a partire da un Ossido Basico e acqua
caratteristiche generali
“ un ossido basico reagisce con l'acqua per dare un idrossido „
Gli ossidi basici prendono questo attributo per il tipo di reazioni che fanno in acqua.
Reagiscono formando una classe di composti che si comportano da BASI, in soluzione acquosa e che sono chiamati IDROSSIDI.
Ossido Basico + Acqua ----> Idrossido (una Base)
Anche gli Idrossidi sono composti ionici:
Uno ione è sempre OH- (ione idrossido) l'altro è il catione derivato dal metallo di partenza.
Me+n(OH)n
Dove n è il numero di ossidazione, in questo caso il numero di elettroni che ogni atomo di metallo ha donato all'Ossigeno.
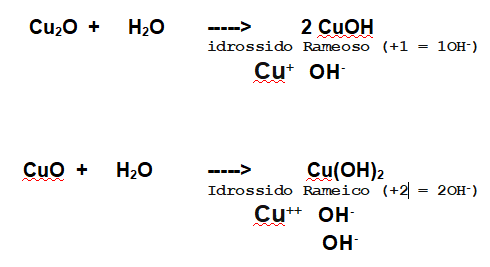
Per quanto riguarda il Rame quindi avremo le due possibilità derivate dai due ossidi che abbiamo formato in precedenza.
Ossido Rameoso - 1 elettrone donato - un catione con una carica positiva - un OH-
Ossido Rameico - 2 elettroni donati - un catione con due cariche positive - due OH-
4- Formazione degli ossidi acidi o anidridi
caratteristiche generali
“ I non-Metalli con l'Ossigeno formano ossidi acidi „
Non-Metallo + Ossigeno ----> Ossido acido (anidride) (composto covalente)
L'Ossigeno reagisce bene anche con i non Metalli.
In questo caso il composto che si forma, data l'elevata elettronegatività di entrambi i reagenti non genera un composto ionico ma un composto covalente.
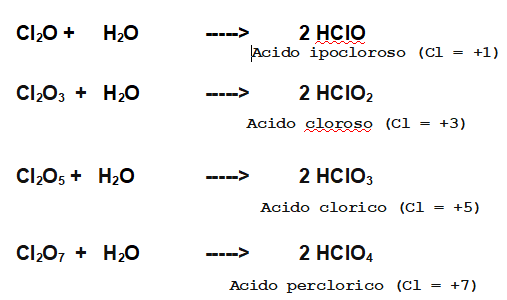
Prendiamo ad esempio la reazione tra Ossigeno e Cloro.
Il Cloro, in associazione con l'Ossigeno può condividere 1 elettrone ma anche mettere in gioco le altre tre coppie di elettroni di valenza a sua disposizione.
Abbiamo quindi ben 4 diverse anidridi e il numero di ossidazione del Cloro può assumere, a seconda dei casi, i valori +1, +3,+5 e +7.

5- Formazione degli ossiacidi a partire da ossidi acidi e acqua
caratteristiche generali
“ Gli ossidi acidi reagiscono con l'acqua per formare gli Ossiacidi „
Ossido acido (anidride) (composto covalente) + Acqua ----> Ossiacido (acido) (composto covalente)
Questi composti si comportano da ACIDI e in soluzione acquosa liberano 1 o + H+.
La loro formula generica è HmMeOn
Dove m è il numero di atomi di idrogeno presenti nella molecola, n il numero di atomi di Ossigeno presenti nella molecola.
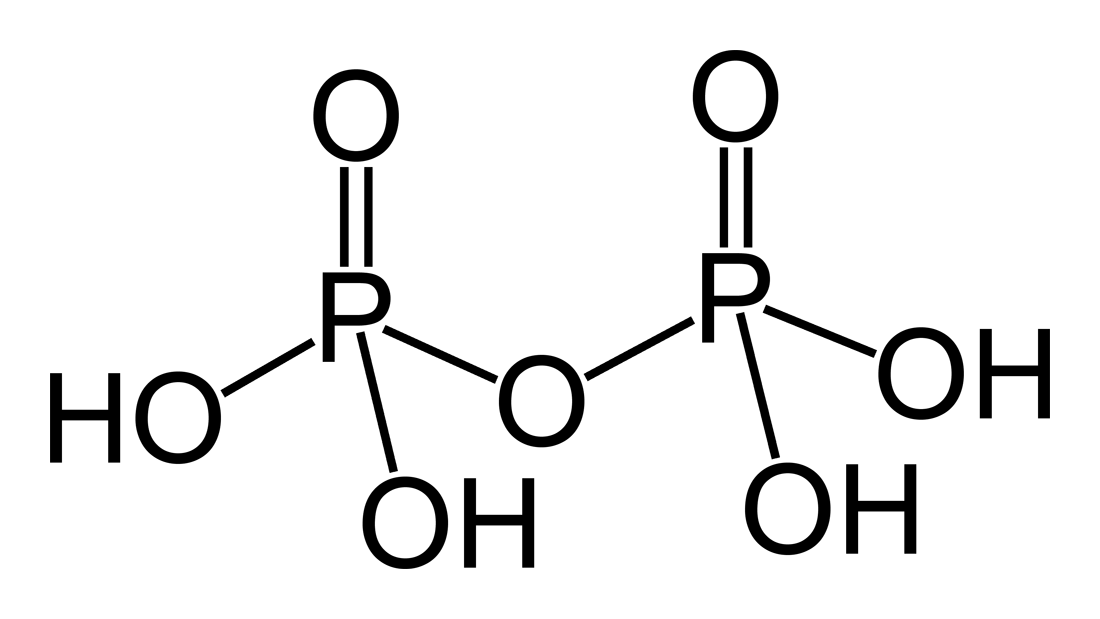
Per quanto riguarda gli atomi di non-Metallo presenti, in molti acidi sono limitati a uno solo, in altri ossiacidi possono essere più di uno.
Ad esempio nell'acido Pirofosforico ci sono due atomi di Fosforo:
Vediamo i 4 acidi che si formano dalle 4 anidridi del Cloro trattate in precedenza.
In breve le reazioni di sintesi che coinvolgono l'Idrogeno
6- Formazione degli idruri covalenti
Idrogeno + (N, P, O) ----> Idruro Covalente (composto covalente)
Ad esempio l'Acqua H2O, la Fosfina PH3, l'Ammoniaca NH3 e pochi altri. Composti covalenti.

7- Formazione degli idruri metallici
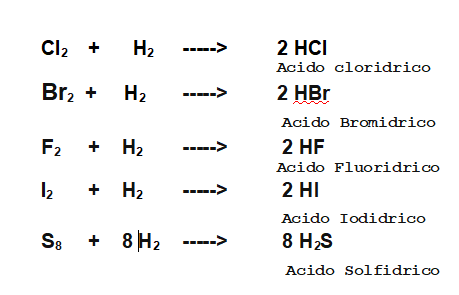
Idrogeno + (F, Br, Cl, I e S) ----> Idracidi (acidi binari)
L'idrogeno può reagire con un gran numero di metalli.
8- Formazione degli idracidi
Idrogeno + Me ----> Idruro Metallico (prevalentemente ionici)
L'idrogeno può reagire con atomi molto elettronegativi per formare gli Idracidi, molecole a carattere acido, di diversa forza, in grado di cedere 1 o 2 ioni H+, in soluzione acquosa.