Risolvere un problema sulla seconda legge di Gay-lussac
inserita il 01-02-2023
“ Risolviamo un problema usando la proporzionalità diretta P/T=K „
In questa videolezione impariamo a risolvere un problema sulla seconda legge di Gay-lussac o legge isocora
MATERIA: Fisica/Chimica;
Calibrato per: classi prime superiori - biennio scienze integrate
ARGOMENTO: Le leggi dei gas
Abbiamo studiato nella pagina precedente La seconda legge di Gay-lussac e abbiamo fatto un paio di esempi su come risolvere gli esercizi e i problemi con le formulazioni che comprendono P0, usando l'equazione empirica riportata qui sotto
“ Seconda legge a temperatura centigrada „
Pt= P0αt + P0
Dove:
P0 = pressione esercitata dal gas a zero gradi centigradi
Pt = pressione esercitata dal gas alla temperatura t in gradi centigradi
t= temperatura a cui ho portato il gas espressa in gradi centigradi
α 1/273,15
“ Prima legge a temperatura Kelvin „
Abbiamo poi visto che c'è un modo più semplice ed esplicito di descrivere matematicamente questa legge se usiamo la scala Kelvin: una semplice proporzionalità diretta tra Pressione e Temperatura
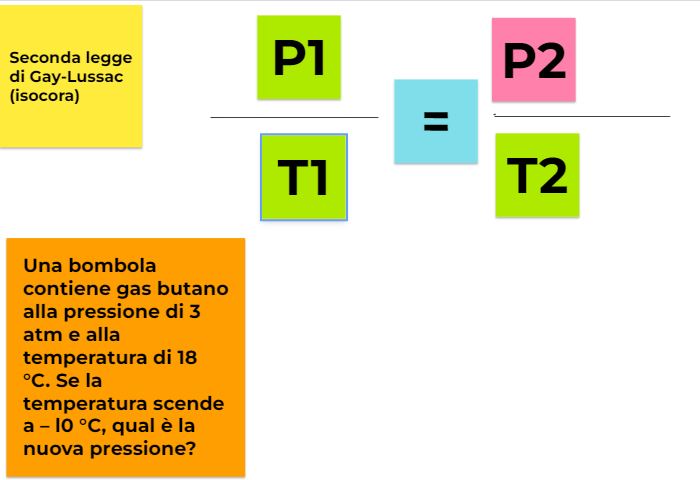
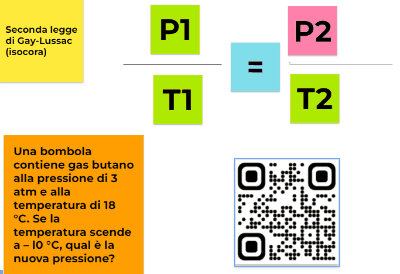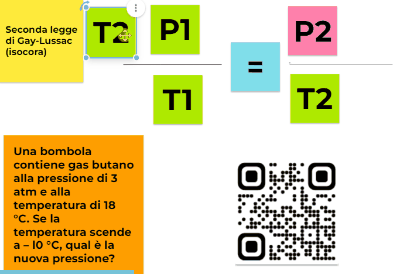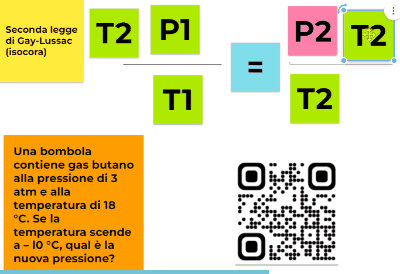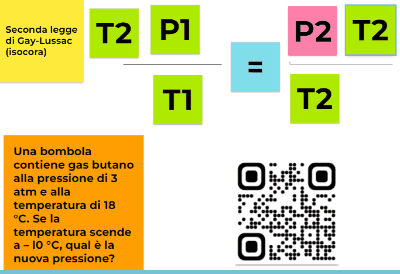
P/T= k
per cui se considero due stati diversi e indico P1 la pressione del gas alla temperatura T1 e P2 la pressione del gas a una temperatura T2 il loro rapporto non varia. Quindi otteniamo una formulazione della seconda legge di Gay-Lussac più maneggevole e svincolata dalla conoscenza del valore di P0
P1/T1=P2/T2=k
In questa videolezione vi spiego come affrontare un problema utilizzando proprio questa seconda formulazione e imparando a usare le formule inverse per isolare la grandezza incognita che ci serve.
Nel caso del video la nostra incognita è P2
Nel resto della pagina farò qualche altro esempio con incognite diverse...
Videolezione: Risolvere un problema sulla seconda legge di Gay-Lussac con incognita P2
Verifichiamo che il risultato sia lo stesso con la formulazione empirica della legge di Charles
Dai dati del video sappiamo che la pressione a 25°C o 298,15 K (T1) è di 4 atmosfere (P1)
Quindi a 0°C (T2) la pressione è:
P2=P1*T2/T1 sostituendo P2=4*273,15/298,15 = 3,66 atomsfere
Nel video il risultato che otteniamo per la pressione a 227°C o 500 K è 6,71 atmosfere
vediamo se otteniamo lo stesso risultato anche con l'altra formulazione con P0
Dal video sappiamo che:
P0 = 3,66 atm
P227°C = ?
t= 227 °C
Applichiamo la formula con P0
Pt= P0αt + P0sostituiamo
P227°C= 3,66 X 1/273,15 X 227 + 3,66
Usando la calcolatrice otteniamo come risultato proprio: 6,70 atm (è leggermente diverso solo perché nel video non sono stato precisissimo con le temperature trascurando di aggiungere lo 0,15)
Ora facciamo qualche esempio con le formule inverse usando la proporzionalità diretta
Esempio 1: incognita P2
Una bombola contiene gas butano alla pressione di 3 atm e alla temperatura di 18 °C. Se la temperatura scende a – l0 °C, qual è la nuova pressione?
tappa 1: trasformare tutte le temperature in Kelvin!
Devo sommare 273,15 alla temperatura centigrada. (Ricorda che 0°C = 273,15 K)
18 °C = 291,15 K = T1 - temperatura iniziale
-10 °C = 263,15 K = T2 - temperatura finale
Il mio terzo valore noto è la pressione a 18 °C per cui:
P1 = 3 atm
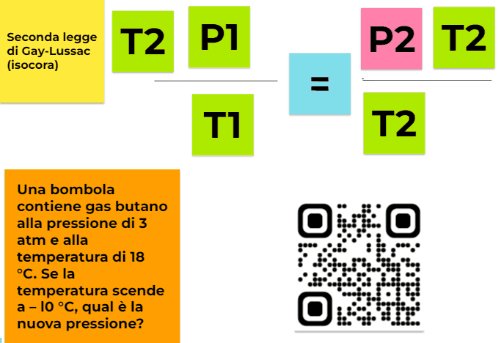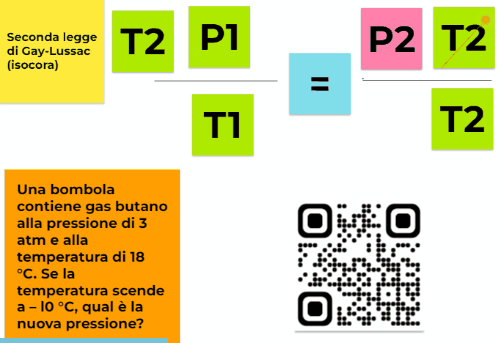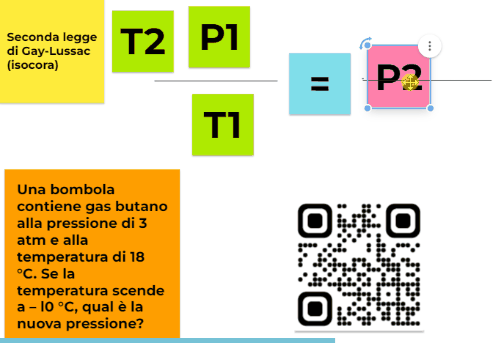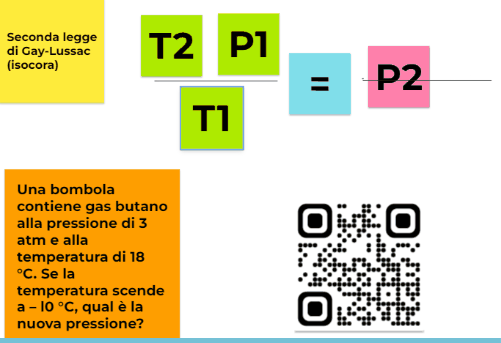
La mia incognita è invece P2
P2 = ?
Partiamo dalla nostra equazione originale e isoliamo P2 in modo da poterne calcolare il valore
La regola è molto semplice: se un termine è al numeratore della frazione da un lato dell'equazione quando si porta dall'altro lato va al denominatore;
se un termine è al denominatore della frazione da un lato dell'equazione quando si porta dall'altro lato va al numeratore;
Come già spiegato in questa pagina, leggetela se avete qualche difficoltà con le formule inverse, questa regola non è una semplice astrazione ma si basa semplicemente su una serie di passaggi matematici
Dato che l'ho già spiegata nella pagina sopra qui mi limito solo a illustrarla una volta
In questo caso se moltiplico entrambi i lati dell'equazione per T2 il risultato ovviamente non cambia
Ora nel lato destro, quello dove c'è P2 che devo isolare c'è T2/T2 che posso semplificare in quanto uguale a 1.
In questo modo con due semplici passaggi ho ottenuto il risultato di isolare la mia incognita P2 e di "passare" T2 dall'altra parte dell'equazione!
Adesso posso sostituire i valori e risolvere il problema
per cui 263,15*3/291,15= 2,71 atm
Esempio 2: incognita T2
Calcola a quale temperatura (in °C) bisogna portare un dato volume di idrogeno, che a 10 °C ha una pressione di 4,93 atm, affinché passi a 2,0 atm.
tappa 1: trasformare tutte le temperature in Kelvin!
Devo sommare 273,15 alla temperatura centigrada. (Ricorda che 0°C = 273,15 K)
10 °C = 283,15 K = T1 - temperatura iniziale
P1 = 4,93 atm - Pressione iniziale
P2 = 2,0 atm - Pressione finale
La mia incognita è quindi T2
T2 = ? - temperatura finale
Partiamo dalla nostra equazione originale e isoliamo T2 in modo da poterne calcolare il valore. Lo abbiamo già fatto nei problemi con il volume e quindi il procedimento è analogo. Ve lo riassumo in un'unica gif, se volete i dettagli guardate la pagina sui problemi risolti sulla legge di Charles.
Moltiplico entrambi i lati dell'equazione per T2 e semplifico
Divido entrambi i lati dell'equazione per P1 e semplifico
Moltiplico entrambi i lati dell'equazione per T1 e semplifico
In questo modo ho ottenuto il risultato di isolare la mia incognita T2
Adesso posso sostituire i valori e risolvere il problema
per cui T2= 2 *283,15/4,93 = 114,87 K
Come ultimo passaggio, dato che la temperatura nel testo era data in gradi centigradi, trasformo il mio risultato in Kelvin in centigradi semplicemente sottraendo 273,15
per cui 114,87-273,15 = -158,28 °C Per cui per ridurre la pressione a 2 atm, meno della metà di quella iniziale, devo portare l'Idrogeno a quasi 160 °C sotto zero!!!
Risoluzione di problemi sulla seconda legge di Gay-Lussac
Spiegazione e simulazione della seconda legge di Gay-Lussac
Esercizi sulla legge di Charles o prima legge di Gay-Lussac
Spiegazione e simulazione della legge di Charles o prima legge di Gay-Lussac
Utilizzare un simulatore per dimostrare la legge di Boyle
problema sulla legge di Boyle con V2 come incognita
problema sul calore specifico con c come incognita