La legge di Boyle
inserita il 25-01-2023
“ La legge di Boyle è una delle tre leggi dei gas perfetti „
In questa videolezione studiamo la legge di Boyle o legge isoterma
MATERIA: Fisica/Chimica;
Calibrato per: classi prime superiori - biennio scienze integrate
ARGOMENTO: Le leggi dei gas
La legge di Boyle è una delle tre leggi dei gas perfetti. Sono leggi sperimentali e si basano sulla misurazione in laboratorio.
Le tre leggi dei gas perfetti analizzano il comportamento dei gas misurando le variazioni dei 3 parametri fondamentali: Temperatura, Pressione e Volume.
La legge di Boyle nello specifico analizza la variazione di Pressione e Volume quando viene mantenuta la Temperatura costante!; quindi la temperatura non varia in questi problemi
“ Cosa afferma la legge di Boyle? „
La legge di Boyle afferma che se la Temperatura è costante, legge isoterma (iso-stessa, terma-temperatura), il prodotto della pressione per il volume PxV resta costante!
Questa osservazione empirica implica che Pressione e Volume sono inversamente proporzionali:
Per cui se il mio gas è contenuto in un recipiente che può variare di volume, ad esempio un palloncino gonfio di elio o un cilindro con pistone mobile, se la Pressione aumenta il Volume del recipiente diminuisce, se la Pressione diminuisce il volume del recipiente aumenta.
Quindi quando affrontiamo lo studio del comportamento di un gas ideale o perfetto abbiamo almeno due situazioni:
la situazione iniziale nella quale indichiamo con P1 la pressione iniziale e V1 il volume iniziale
e la situazione finale nella quale indichiamo con P2 la pressione finale e V2 il volume finale. Boyle quindi, in base alle sue osservazioni sperimentali e al netto degli inevitabili errori di misura, ha affermato che:
P1xV1=K (la costante è sperimentale)
P2xV2=K (la costante mantiene lo stesso valore)
e quindi
P1xV1=P2xV2 in quanto il valore del prodotto non cambia, purché manteniamo la stessa Temperatura.
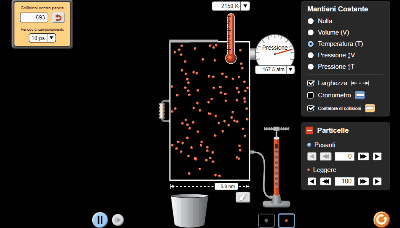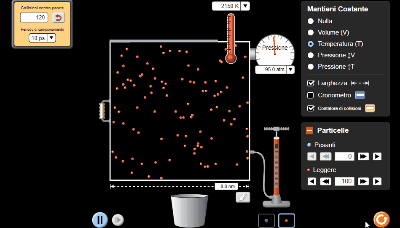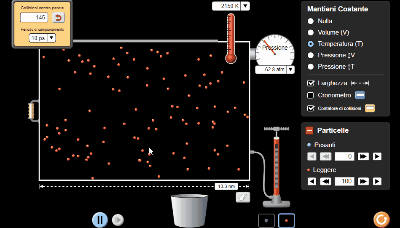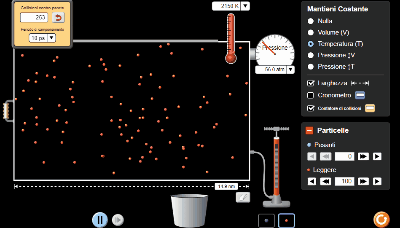
Utilizzare il simulatore del comportamento dei gas perfetti di PHET per spiegare la legge di Boyle
“ Spiegare la legge di Boyle utilizzando un simulatore e graficando i risultati con un foglio elettronico „
Nei due video presenti in questa pagina utilizzo un simulatore del comportamento dei gas perfetti che può essere molto utile per capire la legge di Boyle. il link al simulatore in fondo alla pagina
Il simulatore ci permette di vedere le particelle del gas in movimento. Dall'utilizzo del simulatore è abbastanza evidente perché Pressione e Volume siano così intimamente legati.
Possiamo considerare la pressione che il gas esercita sulle pareti del recipiente come l'effetto dell'insieme degli urti delle particelle del gas contro la parete nell'unità di tempo.
Che cosa influenza il numero e l'energia degli urti delle particelle?
In primo luogo la Temperatura del gas.
Infatti, a livello microsopico, la temperatura di un gas è la misura dell'energia cinetica media delle particelle associata alla velocità delle particelle.
Più le particelle vanno veloci più sarà grande il numero degli urti delle particelle contro le pareti del recipiente e, inoltre, sarà maggiore l'energia cinetica media degli urti.
Per eliminare l'effetto della temperatura Boyle decise quindi di operare a Temperatura Costante: legge isoterma.
Quindi le nostre particelle conservano un'energia cinetica media costante.
Cosa succede se vario il Volume?
Se aumento il volume del recipiente aumenta lo spazio che separa le pareti del recipiente e che le particelle devono percorrere per raggiungere una parete. Di conseguenza si riduce il numero degli urti nell'unità di tempo e la Pressione è costretta a diminuire.
Viceversa se riduco lo spazio tra le pareti il volume del recipiente diminuisce e le particelle raggiungeranno con più frequenza le pareti nell'unità di tempo. Di conseguenza la Pressione aumenta.
Mettendo in grafico i valori di Pressione e Volume Boyle ottenne come risultato un'iperbole.
Ho provato il simulatore Phet nei due video sottostanti a diverse temperatura (300K nel primo video e 1522K nel secondo). Al netto degli errori di misura, la pressione tende ad oscillare attorno a un valore medio in base agli urti istantanei sulla parete, ho ottenuto delle iperboli accettabili. Per cui il simulatore è abbastanza attendibile e può essere molto utile per comprendere la legge di Boyle e correlarla con la struttura corpuscolare di un gas.
I due video sono più o meno equivalenti per capire la legge di Boyle e come si può utilizzare il simulatore per cui basta guardarne uno dei due
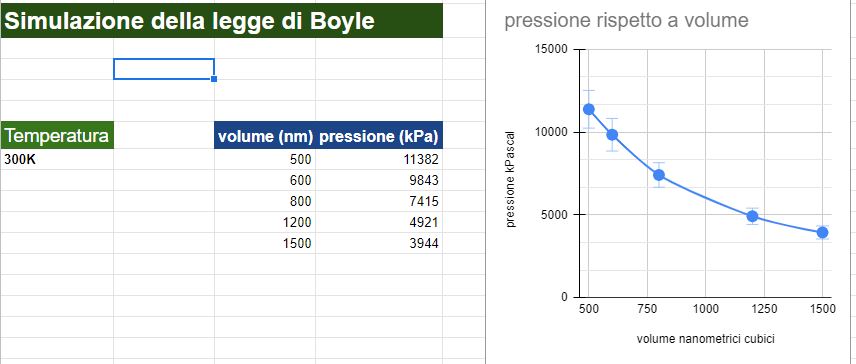
Videolezione 1: simulazione della legge di Boyle a 300K
Risultati della simulazione
Nel primo video ho fissato 5 valori di pressione e volume per ottenere il grafico dell'iperbole.
La temperatura costante l'ho impostata a 300 K.
Numero di particelle di gas inserite 500
Ho poi creato un file excel e graficato i risultati. L'andamento della curva rispecchia l'iperbole attesa. Anche se non perfetta
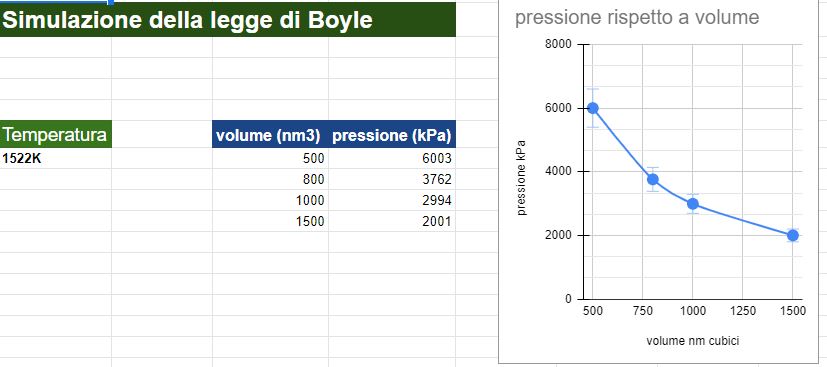
Videolezione 2: simulazione della legge di Boyle a 1522K
Risultati della simulazione
Video analogo al precedente, che spiega la legge di Boyle e spiega come utilizzare il simulatore e impostare i parametri della Temperatura, Volume e numero di particelle.
Qui ho fissato solo 4 coppie di valori di pressione e volume per ottenere il grafico dell'iperbole.
La temperatura costante l'ho impostata a 1522 K.
Ho ridotto il numero di particelle di gas a 50
Ho creato il file excel e graficato i risultati. L'andamento della curva rispecchia l'iperbole attesa, ma con soli 4 punti dati non è proprio l'ideale.
Conclusioni sull'utilizzo del simulatore
L'utilizzo di questo simulatore offerto da PHET del comportamento dei gas perfetti può essere molto utile per spiegare la legge di Boyle e le altre leggi dei gas perfetti in quanto consente di modificare e mantenere costanti tutti e 3 le grandezze che determinano tale comportamento, Temperatura, Pressione e Volume.
Decidere quante particelle di gas inserire nel recipiente, e monitorare gli urti contro la parete, l'energia cinetica media e la velocità delle particelle stesse (non usato nei video)
Si può usare anche per dare delle esercitazioni da fare a casa, o in classe agli alunni e, utilizzando Excel, graficare i risultati.
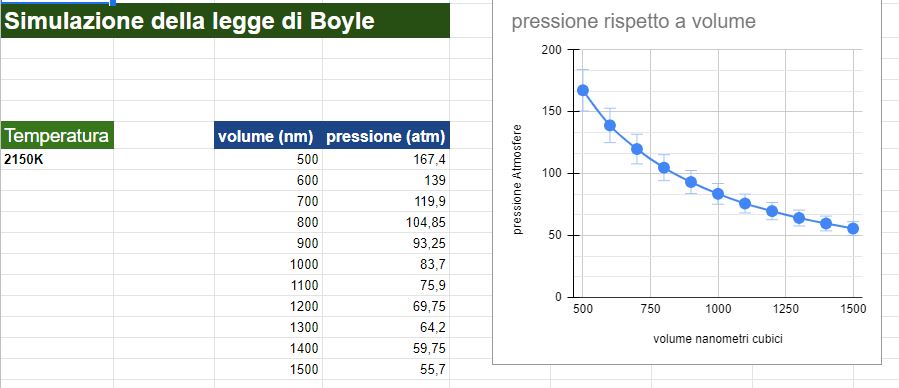
Come ultima prova ho utilizzato il simulatore per ottenere un numero maggiore di punti dati e in questo caso l'iperbole, tolti gli errori di misurazione dovuti all'oscillazione del valore della pressione, si avvicina di molto all'idealità.
Qui sotto vi riporto il grafico con i risultati:
11 coppie di valori di pressione e volume.
La temperatura costante l'ho impostata a 2150 K.
Risoluzione di problemi sulla seconda legge di Gay-Lussac
Spiegazione e simulazione della seconda legge di Gay-Lussac
Esercizi sulla legge di Charles o prima legge di Gay-Lussac
Spiegazione e simulazione della legge di Charles o prima legge di Gay-Lussac
Utilizzare un simulatore per dimostrare la legge di Boyle
problema sulla legge di Boyle con V2 come incognita
problema sul calore specifico con c come incognita